Atoomkern
Een atoomkern of nucleus vormt het centrum van een atoom, en bestaat uit nucleonen. Er zijn twee soorten nucleonen, namelijk positief geladen protonen, en ongeladen neutronen. Een proton en een neutron hebben vrijwel dezelfde massa, namelijk 1 atomaire massa-eenheid.
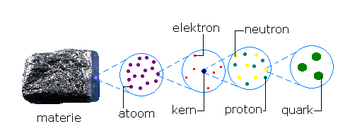
Rondom de positief geladen kern, bevindt zich een negatief geladen 'wolk' van elektronen. Doordat de kern positief geladen protonen en ongeladen neutronen bevat, is ze positief geladen. Het aantal negatief geladen elektronen in de omringende elektronenwolk is echter evenhoog als het aantal protonen in de atoomkern. Daarmee compenseert de negatieve lading van de elektronenwolk de positieve lading van de kern: een atoom als geheel is elektrisch neutraal.
Dit elementaire inzicht in de opbouw van de materie werd in 1911 door Ernest Rutherford ontdekt. Rutherfords ontdekking betekende het begin van de kernfysica.[1] De kern is bijzonder klein, ten opzichte van de gemiddelde afstanden tussen de elektronen, en in vergelijking met de afmeting van het atoom als geheel, maar ze bevat vrijwel de gehele massa van het atoom. De ruimte buiten de kern kan, vanuit het perspectief van de kernfysica, als een praktisch lege ruimte worden opgevat.
De inwendige structuur van de kern of nucleus kan gemodelleerd worden met een schillenmodel voor de protonen en neutronen, dat niet moet worden verward met het elektronenschillenmodel voor het gehele atoom. Het nucleaire schillenmodel werd ontwikkeld in 1950, door Maria Goeppert-Mayer.

Ontdekking van de atoomkern: het goudfolie-experiment
bewerkenHet goudfolie-experiment, ofwel Geiger-Marsden experiment, bestond uit een reeks waarnemingen gedaan door Ernest Rutherford, Hans Geiger en Ernest Marsden tussen 1908 en 1913 in hun laboratorium aan de universiteit van Manchester en resulteerde in de ontdekking dat atomen bestaan uit een kleine, zware positieve kern, met daarrond een uitgestrekte elektronenwolk. Rutherford, Geiger en Marden hingen een dun blaadje goudfolie op en richtten daar een straal alfadeeltjes (helium-4-kernen die van hun elektronen gestript zijn) op. Volgens het in die tijd heersende model van het atoom, Joseph Thomson's krentenbolmodel, zouden de alfadeeltjes onverstoord door de dunne folie van goud atomen heen moeten vliegen. De goudatomen waren immers simpelweg klompen positieve materie met wat negatieve ladingen erin verspreid. Rutherford en zijn assistenten observeerden echter dat de alfadeeltjes van de goudatomen af botsten en alle kanten op verstrooid werden. Uit het specifieke patroon van de verstrooiing van de alfadeeltjes, vastgelegd met fluorescerend papier, konden zij afleiden dat het atoom in werkelijkheid uit een zeer kleine, zware, positief geladen kern moest bestaan, met de elektronen wijd daarrond verspreid.[2][3]
De kernkracht
bewerkenGelijke elektrische ladingen stoten elkaar af. De gravitatiekracht waarmee protonen elkaar aantrekken is een factor 1036 kleiner dan de elektrostatische afstoting tussen de protonen in de kern. Het is dan ook een andere kracht die de atoomkern bij elkaar houdt. Deze wordt de kernkracht genoemd (zwakke kernkracht en sterke kernkracht) en wordt overgebracht door pionen. De kernkracht is een restkracht van de sterke wisselwerking die de quarks binnen de protonen en neutronen bij elkaar houdt. Alleen op afstanden in de grootteorde van enkele kerndeeltjes van de atoomkern is deze kracht werkzaam. Over deze korte afstanden is deze kracht sterker dan de afstotende elektrostatische kracht.
De kernkracht wordt beschreven door de Yukawa-potentiaal en kan vergeleken worden met de vanderwaalskracht. De vanderwaalskracht is een elektrodynamische restkracht tussen neutrale atomen en moleculen die door fotonen wordt overgebracht. De kernkracht houdt de verschillende nucleonen in de kern bij elkaar zoals de vanderwaalskracht de moleculen in elektrisch geladen oliedruppeltjes bij elkaar houdt in de proef van Millikan. Met geladen oliedruppeltjes hebben Millikan en Fletcher in 1909 de elektrische eenheidslading van elektronen bepaald.
Kwantummechanica en hoge-energiefysica
bewerkenDe kernfysica verschilt op een aantal punten van vakgebieden als atoomfysica, vastestoffysica en kwantumchemie:
- het aantal nucleonen in een atoomkern is minstens twee maal zo groot als het aantal elektronen in de elektronenwolk rond de atoomkern,
- de nucleonen hebben hoge energieën zodat berekeningen in relativistische ruimtetijd-stelsels uitgevoerd moeten worden,
- de combinatie van QCD en QED maakt de wisselwerking tussen nucleonen ingewikkeld.
Omdat de wisselwerkingen tussen de nucleonen complexer zijn dan de elektromagnetische wisselwerkingen tussen elektronen in atomen, moleculen en vaste stoffen, is het lastig om voor atoomkernen eenvoudige rekenmodellen te ontwikkelen.
Atoomnummer, massagetal en radioactief verval
bewerkenHet atoomnummer Z is het aantal protonen in de kern. Het bepaalt het chemisch element (en daarmee de chemische eigenschappen) en het aantal elektronen in de elektronenwolk rond de kern van het ongeladen atoom, want de grootte van de negatieve lading van een elektron is exact gelijk aan die van de positieve lading van een proton. Het massagetal A is de som van het aantal protonen en neutronen in de kern. Protonen en neutronen hebben bijna dezelfde massa. Het aantal neutronen N is gelijk aan het verschil van het massagetal en het atoomnummer: N = A − Z. De verschillende isotopen van een element hebben hetzelfde atoomnummer maar verschillende massagetallen. Een nuclide wordt bepaald door het chemisch element en de isotoop daarvan. Dit wordt meestal gespecificeerd met de afkorting van het element, met linksboven de waarde van N. In de kernfysica wordt voor het gemak ook wel de waarde van Z linksonder toegevoegd, zodat in een reactievergelijking de aantallen protonen gemakkelijker gevolgd kunnen worden. Zo is hetzelfde als .
Atoomkernen met een even atoomnummer hebben een hogere abundantie in het zonnestelsel dan elementen met een oneven atoomnummer, zoals aan het zigzagpatroon van de abundanties in de figuur rechts te zien is, omdat de atoomkernen van elementen met een even atoomnummer over het algemeen stabieler zijn dan kernen met een oneven atoomnummer. Verder valt op dat de elementen lithium, beryllium en boor een zeer lage abundantie hebben in vergelijking met waterstof, helium, koolstof-12 en de elementen die volgen. De reden daarvoor is dat beryllium-8 een obstakel vormt tijdens de nucleosynthese en alleen als intermediair aan het triple-alfaproces deelneemt. Naast de nucleosynthese van verschillende isotopen tijdens de oerknal en in sterren is de stabiliteit van de isotopen van zwaardere elementen medebepalend voor de abundantie van de verschillende elementen in het zonnestelsel.[4]
De lijn Z = N en het neutronenoverschot
bewerkenIn de figuur rechts zijn de halveringstijden van de nucliden in kleur aangegeven als functie van het atoomnummer en het aantal neutronen in de kern. Aan het zwarte zigzag patroon en de losse zwarte puntjes van de stabiele nucliden is te zien dat atoomkernen met even aantallen protonen en neutronen over het algemeen stabieler zijn dan kernen met een oneven aantal protonen of neutronen. In de tabellen van de isotopen van koolstof t/m de isotopen van zwavel is te zien dat de nucliden met de hoogste relatieve aanwezigheid en een even atoomnummer op of dicht boven de lijn Z = N liggen.
Naarmate de kernlading hoger wordt komen de stabiele nucliden steeds verder boven de lijn Z = N te liggen. Daaruit blijkt dat kernen met een hoge kernlading stabieler zijn bij een groter neutronenoverschot. Voor middelzware elementen met een even atoomnummer neemt het aantal stabiele isotopen toe. Helium en koolstof hebben 2, zuurstof, neon, magnesium, silicium, argon, chroom en ijzer hebben 3, zwavel en calcium hebben 4 en titanium en nikkel hebben 5 stabiele isotopen.
De massagetallen A = 2 n en A = 4 n
bewerkenDe massagetallen en neutronenoverschotten van de isotopen met de hoogste relatieve aanwezigheid (RA) en bindingsenergie (BE) van zuurstof t/m nikkel zijn:
| Element | O | Ne | Mg | Si | S | Ar | Ca | Ti | Cr | Fe | Ni | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Z | 8 | 10 | 12 | 14 | 16 | 18 | 20 | 22 | 24 | 26 | 28 | |
| hoogste RA | A | 16 | 20 | 24 | 28 | 32 | 40 | 40 | 48 | 52 | 56 | 58 |
| NO | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 4 | 4 | 4 | 2 | |
| hoogste BE | A | 16 | 22 | 26 | 30 | 34 | 38 | 46 | 50 | 54 | 58 | 62 |
| NO | 0 | 2 | 2 | 2 | 2 | 2 | 6 | 6 | 6 | 6 | 6 | |
Deze tabel laat zien dat de massagetallen en de neutronenoverschotten van isotopen met:
- de hoogste relatieve aanwezigheid meestal deelbaar zijn door vier,
- de hoogste bindingsenergie even zijn maar meestal niet deelbaar zijn door vier.
Door de belangrijke rol die helium-4 tijdens de nucleosynthese speelt is de relatieve aanwezigheid van isotopen met een massagetal dat deelbaar is door vier meestal hoog.
Het periodiek systeem, magische getallen en stabiliteit
bewerkenHet periodiek systeem der elementen is ingedeeld op basis van de atoomnummers en de chemische eigenschappen van de elementen. Voor de indeling van het periodiek systeem spelen de elektronenconfiguraties van edelgassen een belangrijke rol. De atomen van helium, neon, argon, krypton, xenon, radon en oganesson hebben respectievelijk 2, 10, 18, 36, 54, 86 en 118 elektronen en een gesloten buitenste elektronenschil. Voor isotopen bestaan er twee reeksen getallen met atoomnummers van kernen van de meest stabiele elementen. Die getallen worden door kernfysici magische getallen genoemd.
Magische getallen
bewerkenDe magische getallen zijn ontdekt tijdens de ontwikkeling van het nucleair schillenmodel in 1950 door Maria Goeppert-Mayer. Zij luiden: 2, 8, 20, 28, 50, 82, en 126. Atoomkernen met een aantal protonen of neutron gelijk aan een magisch getal zijn extreem stabiel omdat zij een volledig gevulde 'kernschil' hebben. Deze schillen zijn niet te verwarren met de elektronenschillen van het gehele atoom. Hier gaat het om orbitalen (schillen) voor de protonen en neutronen binnenin de kern. De bevinding van de magische getallen vormde de basis voor de ontwikkeling van het nucleair schillenmodel.
Elementen met een aantal protonen gelijk aan een magisch nummer zijn respectievelijk helium-4, zuurstof-16, calcium-40, nikkel, tin en lood-208.[5][6][7] Een element met 126 protonen is vooralsnog niet ontdekt.Isotopen waarvan zowel het aantal protonen als het aantal neutronen een magisch getal is worden dubbel-magische isotopen genoemd.
Elementen met stabiele isotopen
bewerkenEr zijn 80 elementen met minstens één stabiele isotoop: die met de atoomnummers 1 t/m 82 (lood), behalve de elementen technetium en promethium, met de atoomnummers 43 en 61.
Over het algemeen zijn de even-even-isotopen, met een even aantal protonen en een even aantal neutronen, waarvan het neutronenoverschot niet te klein of te groot is, stabiel. De elementen met een oneven atoomnummer hebben over het algemeen minder stabiele isotopen dan elementen met een even atoomnummer.
Zeer stabiele isotopen
bewerkenDe isotopen met een van de magische getallen als atoomnummer hebben een singlet grondtoestand met even pariteit. De meest stabiele isotopen uit de reeksen magische getallen zijn:
- Helium-4 met atoomnummer 2 is een zeer stabiel, dubbel magisch isotoop. Het komt als α-deeltje vrij bij talloze vervalprocessen en het speelt een belangrijke rol tijdens de nucleosynthese van andere elementen.
- Koolstof-12 met atoomnummer 6 is een dubbel magisch isotoop. Het is het product van het triple-alfaproces en het speelt een belangrijke rol als katalysator in de koolstof-stikstofcyclus.
- Zuurstof met atoomnummer 8 heeft 3 stabiele isotopen waarvan het dubbel magische isotoop zuurstof-16 de hoogste relatieve aanwezigheid heeft. Zuurstof-16 ontstaat onder andere door de kernfusie van koolstof-12 en helium-4 en het speelt een belangrijke rol in de stikstof-zuurstofcyclus en de zuurstof-fluorcyclus.
- Silicium met atoomnummer 14 heeft 3 stabiele isotopen waarvan het dubbel magische isotoop silicium-28 de hoogste relatieve aanwezigheid heeft.
- Calcium met atoomnummer 20 heeft 5 stabiele isotopen waarvan het dubbel magische isotoop calcium-40 de hoogste relatieve aanwezigheid heeft. Bovendien heeft het dubbel magische isotoop calcium-48 met 20 protonen en 28 neutronen in de kern een zeer lange halveringstijd van 5,39 × 1019 jaar.
- Nikkel met atoomnummer 28 heeft 5 stabiele isotopen waarvan nikkel-58 de hoogste relatieve aanwezigheid heeft. Nikkel-62 heeft van alle isotopen de hoogste bindingsenergie per nucleon.
- Het hoofdgroepmetaal tin met atoomnummer 50 heeft 7 stabiele isotopen met een even massagetal en een 0+ kernspin en 3 stabiele isotopen met een oneven massagetal en een ½+ kernspin. Daarmee is tin het element met het grootste aantal stabiele isotopen.
- Lood met atoomnummer 82 is met 4 stabiele isotopen het laatste element dat stabiele isotopen heeft. Het dubbel magische isotoop lood-208 heeft 82 protonen en 126 neutronen in de kern.
Stabiele oneven-oneven-isotopen
bewerkenOver het algemeen zijn isotopen met een oneven atoomnummer en een oneven aantal neutronen instabiel.
Er zijn vier isotopen die een uitzondering vormen op deze regel:
- Deuterium heeft een grondtoestand met een proton en een neutron elk in een 1s1/2-orbitaal. Deuterium heeft kernspin 1+ en kent geen aangeslagen toestanden.
- Lithium-6 heeft 3 protonen en 3 neutronen en kernspin 1+. Lithium-6 heeft een relatieve aanwezigheid van 7,6 %.
- Boor-10 heeft 5 protonen en 5 neutronen en kernspin 3+. Boor-10 heeft een grote werkzame doorsnede voor neutronenvangst en een relatieve aanwezigheid van 19,9 %.
- Stikstof-14 heeft 7 protonen en 7 neutronen en kernspin 1+. Stikstof-14 heeft een relatieve aanwezigheid van 99,632 %.
Stabiele en instabiele isotopen
bewerkenVan de elementen met een atoomnummer hoger dan 82 bestaan geen stabiele isotopen.
- Over het algemeen zijn oneven-oneven-isotopen erg instabiel waardoor ze op Aarde vrijwel niet voorkomen. Ze vervallen meestal door bètaverval of door elektronenvangst naar een even-even-isobaar.
- Van de elementen technetium en promethium, met de atoomnummers 43 en 61, bestaan geen stabiele isotopen.
- Hoewel beryllium-8 een even-even-isotoop is, is het opmerkelijk instabiel. Beryllium-8 valt door spontane kernsplijting direct uit elkaar in twee helium-4-kernen.
- Er bestaan geen stabiele isotonen met 19, 21, 35, 39, 45, 61, 71, 84, 89 of 97 neutronen.
Metastabiele isotopen
bewerkenDe halveringstijden van enkele isotopen van sommige instabiele elementen is zo lang dat ze na 4,5 miljard jaar nog als metastabiel isotoop op Aarde voorkomen.
- De isotopen kalium-40, vanadium-50, lanthaan-138, lutetium-176 en tantaal-180m1 zijn metastabiele oneven-oneven-isotopen.
- Bismut-209 heeft atoomnummer 83 en een halveringstijd van 1,9 × 1019 jaar.
- Thorium-232, uranium-238 en uranium-235 hebben halveringstijden van ongeveer 1,4 × 1010, 4,5 × 109 en 7,0 × 108 jaar.
Structuur van de atoomkern: nucleair schillenmodel
bewerkenNadat Ernest Rutherford[2] aan het begin van de twintigste eeuw ontdekt had dat de positieve lading, en bijna alle massa, van een atoom in een zware en minuscule kern samengepakt zit, en dus bestaat uit protonen en neutronen, duurde het nog bijna een halve eeuw tot de inwendige structuur van de protonen en de neutronen binnenin die kern ontsluierd werd. Het antwoord kwam in de vorm van het nucleair schillenmodel.
Het kernschillenmodel werd ontwikkeld door Maria Goeppert Mayer aan het eind van de jaren '40 en het begin van de jaren '50 van de twintigste eeuw naar analogie met het atomaire schillenmodel.[8][9] Het is een semi-empirisch model waarin de straal R van de atoomkern, de potentiaal V(r) en spin-baankoppeling de belangrijkste rollen vervullen. Protonen en neutronen zijn fermionen omdat ze een halftallige spin hebben. In het nucleair schillenmodel kan elk nucleon zich binnen de bolsymmetrische potentiaalput van de kern vrij bewegen in het gemiddelde veld van alle andere nucleonen, zoals de deeltjes in een Fermigas.
Het nucleair schillenmodel levert verklaringen voor de kernspin en pariteit van de grondtoestand van kernen met een massagetal tot 150 en voor kernen met een massagetal tussen 190 en 220. De resultaten van berekeningen van het magnetisch moment en het elektrisch quadrupool moment stemmen voor veel kernen goed overeen met gemeten waarden. De kernen met een massagetal tussen 150 en 190 zijn afwijkend, onder meer omdat ze niet bolsymmetrisch zijn. Het nucleair schillenmodel biedt de basis voor de ontwikkeling van meer geavanceerde modellen, zoals modellen waarin bijvoorbeeld correlaties tussen nucleonen meegenomen kunnen worden als in een Fermivloeistof.[10]
Nucleaire orbitalen
bewerkenDe subatomaire deeltjes in de kern zoeken de kwantumtoestand met de laagste energie op. De golffunctie van de nucleonen is, net als de golffunctie van de elektronen in een atoom, opgebouwd uit orbitalen. De oplossingen van de Schrödingervergelijking bestaan uit de producten van sferische harmonischen Yℓm(θ, φ), met de bijbehorende radiale functies, Rℓ(r). De sferische harmonischen zijn de oplossingen van de Laplace-vergelijking in bolcoördinaten.
Kernstraal
bewerkenEen atoomkern is geen harde bol. De straal van de kern geeft de grootte van de bol aan waarbinnen de nucleonen zich vrij kunnen bewegen. De kernstraal wordt berekend aan de hand van het massagetal A en uitgedrukt in femtometers:
Deze waarde kan worden vergeleken met de kernstraal die bepaald is met behulp van verstrooiingsexperimenten.
Kernpotentiaal
bewerkenDe modelpotentiaal waarvoor gekozen is houdt het midden tussen een rechthoekige potentiaalput, met V(r) = −V0 als r < R, en een potentiaal van een harmonische oscillator, met V(r) = ½ kF r2 − V0 als r < R.
De potentiaal voor de modelberekeningen wordt gegeven door een S-functie:
waarin de parameter −V0 de diepte van de potentiaal is en a de huiddikte van de potentiaal. Voor a wordt 0,524 fm genomen en de waarde van V0 ligt rond de 50 MeV.[10]
Voor r << R geldt V(r) = −V0, voor r = R geldt V(r) = −½V0 en voor r >> R geldt V(r) = 0.
Radiale functies en kwantumgetallen
bewerkenDe radiale functies in het nucleaire schillenmodel zijn afgeleid van oplossingen van de Schrödingervergelijking voor harmonische oscillatoren en rechte potentiaalputten in drie dimensies. De radiale functies zijn niet afgeleid van oplossingen van de Schrödingervergelijking voor de coulombpotentiaal, zoals de Slater-type orbitalen of de Laguerre-polynomen, die de basis vormen van de radiale golffuncties van atomen. Daarom worden de toegestane waarden van nevenkwantumgetallen in een nucleair schillenmodel niet beperkt door de waarde van een hoofdkwantumgetal. Daarom bestaan de 1s, 1p, 1d, 1f, 2d, 2f ... orbitalen in een nucleair schillenmodel terwijl het atomaire schillenmodel geen 1p, 1d, 1f, ... en 2d, 2f, ... orbitalen kent.
Spin-baankoppeling
bewerkenDe nucleonen hebben een spin en een magnetisch moment en ze bewegen in orbitalen met een impulsmoment. Daarom kan aan de Hamiltoniaan een spin-baankoppeling toegevoegd worden:
De spin-baankoppeling splitst de 2(2l + 1)-voudig ontaarde energieniveaus van de orbitalen met l > 0 op in energieniveaus met een totaal impulsmoment van j = l + s of j = l − s. Elk nieuw energieniveau heeft 2j + 1 orbitalen:
- De twee 1s orbitalen worden twee 1s1/2 orbitalen.
- De zes 1p orbitalen splitsen op in twee 1p1/2 orbitalen en vier 1p3/2 orbitalen.
- De tien 1d orbitalen splitsen op in vier 1d3/2 orbitalen en zes 1d5/2 orbitalen.
De verschuiving van de energieniveaus door de spin-baankoppeling wordt gegeven door:
zodat de splitsing ΔSO gegeven wordt door:
Door de spin-baankoppeling aan de Hamiltoniaan toe te voegen kan voor kernen de ligging en de volgorde van de energieniveaus vrij goed benaderd worden.[10]
Statistische mechanica bij T = 0 K
bewerkenDe protonen en neutronen bezetten de beschikbare energieniveaus in een kern volgens de Fermi-Diracstatistiek:
De afstand tussen de energieniveaus in een kern is onder standaardomstandigheden groot in vergelijking met de energie van de temperatuurbeweging kB T.[11][12] Daarom zijn onder standaardomstandigheden de energieniveaus t/m het Fermi-niveau volledig bezet zoals bij een statistische verdeling bij het absolute nulpunt.
Over het algemeen is het thermodynamisch gunstig wanneer geen enkele orbitaal onbezet blijft en elektrische en magnetische velden zo klein mogelijk zijn. Daarom zijn radicalen en tripletzuurstof zo reactief en vervallen zware atoomkernen met een groot neutronenoverschot en een even aantal nucleonen vaak via α- en β-verval naar een singlet grondtoestand.
Kernfusie
bewerkenDe temperatuur waarbij een bepaalde kernreactie kan verlopen hangt af van de activeringsenergie EA en ligt in de orde van grootte van T = EA / kB. De temperatuur in de kern van de Zon ligt rond de 15,7 × 106 K en is hoog genoeg om de kernfusiereacties van de CNO-cyclus te laten verlopen.
Massa-overschot en bindingsenergie
bewerkenDe massa van een kern is niet gelijk aan de som van de massa's van de protonen en neutronen in de kern. Als de uitkomst van deze simpele optelsom met de werkelijke massa van de kern wordt vergeleken dan levert dat een verschil op dat het massadefect van de atoomkern wordt genoemd. Dit massadefect wordt veroorzaakt door de bindingsenergie tussen de nucleonen in de kern die tijdens de nucleosynthese is vrijgekomen.
In de afbeelding rechts is voor de meest stabiele isotopen de bindingsenergie per nucleon tegen hun massagetal uitgezet. Het valt direct op dat de bindingsenergie per nucleon voor kernen met een laag massagetal sterk stijgt als het massagetal toeneemt. Door de kernfusie van lichte kernen komt blijkbaar veel warmte vrij. De elementen met een massagetal lager dan 8 zijn waarschijnlijk tijdens de oerknal-nucleosynthese ontstaan, in een periode van 3 tot 20 minuten na de oerknal. Elementen zwaarder dan lithium en koolstof konden pas gevormd worden door de nucleosynthese in zware sterren.
Voetnoten
- ↑ Krane 2016; Walker 2014
- ↑ a b (en) E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine. Series 6, vol. 21. May 1911. Gearchiveerd op 10 november 2021.
- ↑ (en) Lord Ernest Rutherford. Science Learning Hub. Gearchiveerd op 29 juni 2020. Geraadpleegd op 27 juni 2020.
- ↑ Abundance in the Universe of the elements. Gearchiveerd op 14 mei 2021.
- ↑ Magische getallen van nucleonen. Gearchiveerd op 11 oktober 2021.
- ↑ Goeppert-Mayer, Maria (April 1950). Nuclear configurations in the spin-orbit coupling model. I. Empirical Evidence. Physical Review 78 (1): 16–21. DOI: 10.1103/PhysRev.78.16.
- ↑ Goeppert-Mayer, Maria (April 1950). Nuclear Configurations in the Spin-Orbit Coupling Model. II. Theoretical Considerations. Physical Review 78 (1): 22–23. DOI: 10.1103/PhysRev.78.22.
- ↑ Maria Goeppert Mayer, Nuclear Configurations in the Spin-Orbit Coupling Model. I. Empirical Evidence, Phys. Rev. 78, 16 (1950)
- ↑ Maria Goeppert Mayer, Nuclear Configurations in the Spin-Orbit Coupling Model. II. Theoretical Considerations, Phys. Rev. 78, 22 (1950)
- ↑ a b c Krane 2016
- ↑ filmpje molecuul beweging druk en temperatuur op youtube. Gearchiveerd op 6 november 2019.
- ↑ Verband tussen brownse beweging en temperatuur op youtube. Gearchiveerd op 23 juli 2021.
Literatuur
- (en) De Graef, M. & McHenry, M.E., 2007: Structure of Materials, An Introduction to Crystallography, Diffraction and Symmetry, Cambridge University Press, ISBN 978-0-521-65151-6.
- (en) Introductory Nuclear Physics - Kenneth S. Krane, John Wiley & Sons, New York, ISBN 0-471-85914-1. Gearchiveerd op 9 mei 2016.
- (en) Walker, J., 2014 (10th. ed): Physics, Wiley, ISBN 978-1-118-23072-5.
Historische literatuur
- (en) Bohr, N., 1913: On the constitution of atoms and molecules, Philosophical Magazine 26, pp. 1-25 (part i); pp. 476-502 (part ii); pp. 857-875 (part iii).
- (en) E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine. Series 6, vol. 21. May 1911. Gearchiveerd op 10 november 2021.