Trimethylamine
Trimethylamine of TMA is een van de drie methylamines. Het is een kleurloos, brandbaar gas dat reeds bij zeer kleine concentraties een sterke visgeur verspreidt.
| Trimethylamine | ||||||
|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||||

| ||||||
Structuurformule van trimethylamine
| ||||||
| ||||||
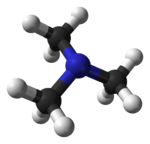
Molecuulmodel van trimethylamine
| ||||||
| Algemeen | ||||||
| Molecuulformule | C3H9N | |||||
| IUPAC-naam | N,N-dimethylmethaanamine | |||||
| Andere namen | TMA | |||||
| Molmassa | 59,11026 g/mol | |||||
| SMILES | CN(C)C
| |||||
| CAS-nummer | 75-50-3 | |||||
| EG-nummer | 200-875-0 | |||||
| PubChem | 1146 | |||||
| Wikidata | Q423953 | |||||
| Beschrijving | Kleurloos gas | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H220 - H280 - H315 - H318 - H332 - H335 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P210 - P261 - P280 - P305+P351+P338 - P410+P403 | |||||
| VN-nummer | 1083 | |||||
| MAC-waarde | 4,9 mg/m³ | |||||
| LD50 (ratten) | (oraal) 500 mg/kg | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | gasvormig | |||||
| Kleur | kleurloos | |||||
| Dichtheid | 0,67 g/cm³ | |||||
| Smeltpunt | −117,08 °C | |||||
| Kookpunt | 2,87 °C | |||||
| Vlampunt | −7 °C | |||||
| Zelfontbrandings- temperatuur | 190 °C | |||||
| Dampdruk | 1900 Pa | |||||
| Oplosbaarheid in water | 475 g/L | |||||
| Matig oplosbaar in | water, ethanol | |||||
| log(Pow) | 0,119 | |||||
| Evenwichtsconstante(n) | pKa = 9,81 | |||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Het is mengbaar met water en naast het trimethylamine in drukhouders wordt het ook geleverd als een oplossing van 40% in water. Daarnaast is ook het hydrochloridezout (trimethylammoniumchloride) commercieel verkrijgbaar.
Synthese
bewerkenTrimethylamine wordt op industriële schaal voornamelijk geproduceerd door de reactie van ammoniak met methanol:[1]
Hierbij worden ook water, monomethylamine (MMA) en dimethylamine (DMA) gevormd. Dit mengsel wordt in meerdere destillatiestappen, waaronder extractieve destillatie, gescheiden.
De stof kan ook bereid worden door reactie van ammoniumchloride met paraformaldehyde:[2]
Hierbij wordt trimethylamine als hydrochloride gevormd.
Eigenschappen
bewerkenTrimethylamine is mengbaar met water en reageert daarbij basisch:
De hogere pKa-waarde (9,81) ten opzichte van die van ammoniak (9,25) kan verklaard worden door het inductief effect die de elektronenstuwende methylgroepen uitoefenen op stikstof.
Trimethylamine is een zwakke base die met sterke zuren zouten vormt. Een van trimethylamine afgeleid zout met een bijzondere structuur (behorende tot de iminiumzouten) is Eschenmoserzout. Dit elektrofiel zout wordt in de organische synthese gebruikt als een stabiele vervanger voor het gasvormige formaldehyde.
Toepassingen
bewerkenTrimethylamine wordt voornamelijk gebruikt voor de synthese van cholinechloride (vitamine B4), een additief voor veevoeder. Andere toepassingen van trimethylamine zijn onder andere in katalysatoren voor organische synthese en in ionenwisselaarharsen.
Trimethylaminuria
bewerkenTrimethylaminuria (ook wel het visgeursyndroom genoemd) is een genetische afwijking waardoor het lichaam niet in staat is om de stof trimethylamine uit voedselbronnen af te breken. Patiënten ontwikkelen hierdoor een karakteristieke vislucht in onder andere: zweet, urine en adem na de consumptie van voedsel rijk aan choline. Trimethylaminuria is een autosomaal recessieve afwijking welke gepaard gaat met een trimethylamine oxidase tekort. Een afwijking welke veel lijkt op trimethylaminuria is aangetroffen bij enkele Rhode Island-kippen wier eieren een vislucht hebben, vooral na het voeren van een flinke hoeveelheid koolzaad dat rijk is aan choline.
Toxicologie en veiligheid
bewerkenOnder normale omstandigheden is trimethylamine een kleurloos, ontvlambaar gas. Het is zeer licht ontvlambaar en vormt gemakkelijk explosieve mengsels met lucht. De oplossing van trimethylamine in water is een sterke base, die hevig reageert met sterke zuren en corrosief is ten opzichte van onder meer aluminium, koper, zink, magnesium en tin.
Trimethylamine heeft een zeer lage geurdrempel, minder dan één ppb). De stof irriteert de ogen en is traanverwekkend. Inademen van trimethylamine leidt tot irritatie van neus en keel, hoesten, kortademigheid, hoofdpijn en ademnood. Bij blootstelling aan grotere concentraties (meer dan 100 ppm) kunnen er misselijkheid, braken, buikkrampen en diarree optreden. Ernstige blootstelling kan leiden tot longschade en longoedeem.
Externe links
bewerken- (en) MSDS van trimethylamine
- (en) Gegevens van trimethylamine in de GESTIS-stoffendatabank van het IFA
- ↑ (en) A.B. van Gysel & W. Musin - Methylamines, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim
- ↑ (en) R. Adams & C.S. Marvel (1921) - Trimethylamine hydrochloride, Org. Synth., 1, p. 79



