N-broomsuccinimide
N-broomsuccinimide of NBS is een organische verbinding met als brutoformule C4H4BrNO2. De stof komt voor als witte kristallen, die slecht oplosbaar zijn in water. N-broomsuccinimide is een belangrijk reagens in de organische chemie.
| N-broomsuccinimide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
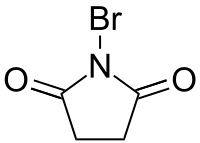
| ||||
Structuurformule van N-broomsuccinimide
| ||||

| ||||
N-broomsuccinimide
| ||||
| Algemeen | ||||
| Molecuulformule | C4H4BrNO2 | |||
| IUPAC-naam | N-broomsuccinimide | |||
| Molmassa | 177,98406 g/mol | |||
| SMILES | C1CC(=O)N(C1=O)Br
| |||
| InChI | 1S/C4H4BrNO2/c5-6-3(7)1-2-4(6)8/h1-2H2
| |||
| CAS-nummer | 128-08-5 | |||
| EG-nummer | 204-877-2 | |||
| PubChem | 67184 | |||
| Wikidata | Q286939 | |||
| Beschrijving | Witte kristallen | |||
| Vergelijkbaar met | N-chloorsuccinimide | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P264 - P270 - P301+P310 - P330 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 2,098 g/cm³ | |||
| Smeltpunt | 174–179 °C | |||
| Oplosbaarheid in water | 14,7 g/L | |||
| Goed oplosbaar in | aceton, ethylacetaat | |||
| Slecht oplosbaar in | water | |||
| Onoplosbaar in | koolstoftetrachloride | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | orthorombisch | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese bewerken
Aangezien N-broomsuccinimide zeer veel gebruikt wordt, is het commercieel verkrijgbaar. Desalniettemin kan het ook in het laboratorium worden bereid. Hierbij worden natriumhydroxide en dibroom aan een gekoelde oplossing van succinimide toegevoegd. Gezien het feit dat N-broomsuccinimide niet goed oplosbaar is in water, slaat het neer en kan het afgefiltreerd worden. Het bekomen product is echter nog niet zuiver: het is niet volledig wit gekleurd, maar lichtgeel.
Een alternatieve methode, die een hogere opbrengst geeft, is via de Wohl-Ziegler-reactie. Ook hier is het product nog niet zuiver.
De zuivering van het bekomen N-broomsuccinimide kan plaatsgrijpen door omkristallisatie uit water, bij 90-95°C.[1]
Structuur en eigenschappen bewerken
N-broomsuccinimide heeft een basisstructuur van pyrrolidine. De binding tussen stikstof en broom is sterk gepolariseerd naar stikstof toe; het elektronegativiteitsverschil tussen beide atomen is hier debet aan. Dit impliceert dat het broomatoom positief gepolariseerd is en dat N-broomsuccinimide bijgevolg een bron van het elektrofiele Br+ is. Door behandeling van N-broomsuccinimide met waterstofbromide ontstaat in situ dibroom:
Toepassingen bewerken
N-broomsuccinimide is een belangrijk reagens in de organische chemie. Het wordt hoofdzakelijk gebruikt om in situ dibroom te genereren. Aangezien dibroom een toxisch en snel verdampende vloeistof is, is het interessanter om in het reactiemengsel zelf dibroom te bereiden. Dat kan met N-broomsuccinimide; bijgevolg is het een bromeringsreagens.
Elektrofiele additie aan alkenen bewerken
Een eerste reactie van N-broomsuccinimide is de elektrofiele additie aan alkenen. NBS reageert met alkenen (1) in waterige oplossing tot broomhydrines (2):
Bij aan normale elektrofiele additie van dibroom zou het vicinaal gebromeerde alkaan moeten ontstaan. Echter, omdat de reactie in waterige midden verloopt en water in overmaat aanwezig is, zal een hydroxylgroep worden ingevoerd in plaats van een bromide.
In aanwezigheid van andere nucleofielen kunnen talrijke bifunctionele alkanen ontstaan. Een voorbeeld is de reactie van cyclohexeen met N-broomsuccinimide in aanwezigheid van fluoride-ionen (onder de vorm van een adduct tussen tri-ethylamine en waterstoffluoride):
Allylische en benzylische bromering bewerken
De allylische en benzylische bromering geschiedt via het refluxen van een oplossing van het substraat en N-broomsuccinimide in watervrij tetrachloormethaan met een radicaalinitiator. Dit is meestal azobisisobutyronitril of benzoylperoxide.[2] De radicalaire intermediairen die gevormd worden zijn over het algemeen stabieler dan gewone koolstofradicalen. Deze reactie wordt ook wel de Wohl-Ziegler-reactie genoemd.[3][4] Onderstaand voorbeeld betreft de allylische bromering van 2-hepteen:
Het gebruikte tetrachloormethaan moet gedurende de volledige reactie watervrij blijven, omdat water meestal de neiging heeft tot sterke hydrolyse van het product.[5] Om dit te realiseren wordt vaak bariumcarbonaat toegevoegd.
α-bromering van carbonylverbindingen bewerken
N-broomsuccinimide kan gebruikt worden voor de α-bromering van carbonylverbindingen: hierbij worden een broomatoom ingevoerd op het α-koolstofatoom naast de carbonylgroep. Dit kan via twee processen verlopen: zure katalyse of radicalair. Een voorbeeldreactie is de α-bromering van hexanoylchloride (1) met behulp van een zure katalysator (waterstofbromide):[6]
Deze reactie wordt preferentieel toegepast bij enolaten, enolethers en enolacetaten, omdat het een hoge opbrengst heeft en omdat er weinig bijproducten worden gevormd.[7][8]
Aromatische bromering bewerken
Talrijke elektronrijke aromatische verbindingen, zoals fenolen, anilines en heterocyclische verbindingen, kunnen gebromeerd worden met N-broomsuccinimide. Het gebruikt van dimethylformamide als oplosmiddel geeft een selectief hogere opbrengst van het para-gebromeerde product.[9]
Toepassing in de Hofmann-omlegging bewerken
N-broomsuccinimide wordt aangewend in de Hofmann-omlegging, waarbij het in aanwezigheid van een sterke base (DBU), reageert met primaire amines tot het overeenkomstige carbamaat:[10]
Selectieve oxidatie van alcoholen bewerken
De selectieve oxidatie van alcoholen met N-broomsuccinimide is een eerder ongewone methode om alcoholen te oxideren. Het is gebleken dat N-broomsuccinimide in staat is om secundaire alcoholen selectief te oxideren in dimethoxyethaan:[11]
Oxidatieve decarboxylering van aminozuren bewerken
N-broomsuccinimide is in staat om het amine in een aminozuur te bromeren, waarna door decarboxylering het imine wordt afgesplitst. Hydrolyse van het imine leidt tot vorming van een aldehyde en ammoniak.
Externe links bewerken
Bronnen, noten en/of referenties
|

