Broompentafluoride
Broompentafluoride is een extreem reactieve interhalogeenverbinding van fluor en broom, met als brutoformule BrF5. Het is een kleurloze tot lichtgele, rokerige vloeistof met een scherpe geur, die hevig reageert met water. Het is een sterke oxidator en een sterk fluoreringsreagens.
| Broompentafluoride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
Structuurformule van broompentafluoride
| |||||
| |||||
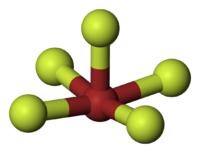
Molecuulmodel van broompentafluoride
| |||||
| Algemeen | |||||
| Molecuulformule | BrF5 | ||||
| IUPAC-naam | broompentafluoride | ||||
| Molmassa | 174,896016 g/mol | ||||
| SMILES | FBr(F)(F)(F)F
| ||||
| CAS-nummer | 7789-30-2 | ||||
| EG-nummer | 232-157-8 | ||||
| PubChem | 24606 | ||||
| Wikidata | Q417069 | ||||
| Beschrijving | Kleurloze tot lichtgele vloeistof | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H242 - H301 - H311 - H314 - H331 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P210 - P220 - P234 - P280 - P370+P378 | ||||
| Opslag | Gescheiden van voeding en voedingsmiddelen. Droog, goed gesloten en in een goed verluchte ruimte bewaren. | ||||
| VN-nummer | 1745 | ||||
| ADR-klasse | Gevarenklasse 5.1 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos-lichtgeel | ||||
| Dichtheid | 2,46 g/cm³ | ||||
| Smeltpunt | −60,5 °C | ||||
| Kookpunt | 40,8 °C | ||||
| Dampdruk | (bij 20°C) 44.000 Pa | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH |
−428,9 kJ/mol | ||||
| ΔfH |
−458,6 kJ/mol | ||||
| S |
320,2 J/mol·K | ||||
| S |
225,1 J/mol·K | ||||
| C |
99,6 J/mol·K | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
bewerkenBroompentafluoride werd voor het eerst bereid in 1930 door middel van een disproportioneringsreactie van broomfluoride. Het nadeel aan deze methode is dat er, naast de gewenste stof, ook dibroom wordt gevormd en daardoor de rendabiliteit van de reactie omlaag wordt gehaald.[1]
Een bereiding met een hoger rendement is de reactie tussen moleculair broom en fluor bij een temperatuur van 150 °C:
Voor de bereiding van kleinere hoeveelheden kan volgende synthese worden aangewend:[2]
Toepassingen
bewerkenBroompentafluoride is zo reactief dat het zuurstof uit silicaten vrijmaakt. Het wordt gebruikt in de analyse van de zuurstofisotoopverhoudingen in geologische materialen, zoals klei. Het kan in nikkel bewaard worden, omdat dit metaal een beschermende fluoridelaag ontwikkelt.
Toxicologie en veiligheid
bewerkenDe stof ontleedt bij verhitting boven 460 °C en bij contact met zuren of zure dampen, met vorming van zeer giftige dampen, zoals waterstoffluoride en waterstofbromide. Ze reageert hevig met:
- brandstoffen en organische verbindingen, producten die waterstof bevatten (zoals ammoniak, azijnzuur, water, vet en papier), waardoor brand- en ontploffingsgevaar ontstaat
- water, waterdamp, vocht en stoom, met vorming van giftige en corrosieve dampen van waterstoffluoride en waterstofbromaat:
- alle bekende elementen, met uitzondering van stikstof, zuurstof en edelgassen
De stof is corrosief voor de ogen, de huid en de luchtwegen. Inademing van de damp of de aerosol kan longoedeem veroorzaken. Blootstelling boven de drempelwaarde van 0,1 ppm (0,72 mg/m³) kan de dood veroorzaken.
Externe links
bewerken- broompentafluoride - International Chemical Safety Card
- (en) MSDS van broompentafluoride
- (nl) Drempelwaarden van verschillende gevaarlijke stoffen
- ↑ (en) N.N. Greenwood & A. Earnshaw - Chemie prvku (Chemistry of the Elements), Informatorium, Praag, 1993
- ↑ (en) G.A. Hyde - Synthesis routes to chlorine and bromine pentafluorides, Inorganic Chemistry 7: pp. 2648–2649, 1968


