Katalysator
Een katalysator is in de scheikunde een stof die de snelheid van een specifieke chemische reactie beïnvloedt zonder zelf verbruikt te worden. Een katalysator verhoogt de reactiesnelheid door de activeringsenergie van een chemische reactie te verlagen. In het geval van een evenwichtsreactie verhoogt de katalysator de snelheid van de heengaande en de teruggaande reactie gelijkmatig. De thermodynamica van de reactie verandert niet: de hoeveelheid energie die verbruikt wordt of vrijkomt bij een reactie is even groot als zonder katalysator, en ook de ligging van het chemisch evenwicht blijft dezelfde.
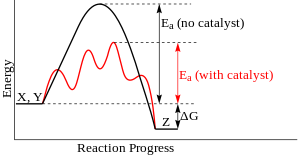
Soms is het praktisch ondoenlijk om reacties te laten verlopen zonder katalysator: de activeringsenergie is dan dusdanig hoog, dat het zonder katalysator eeuwen zou duren voor de evenwichtstoestand wordt bereikt. Een katalysator opent een ander pad waarlangs de reactie kan plaatsvinden. In plaats dat er wordt geprobeerd de reactie direct plaats te laten vinden, worden er (andere) tussenproducten gevormd, waarbij de individuele energiebarrières lager zijn dan de oorspronkelijke.
Katalysatoren kunnen worden onderverdeeld in twee typen: homogene en heterogene katalysatoren. Homogene katalysatoren bevinden zich in het reactiemengsel, en in dezelfde fase als de reactanten. Heterogene katalysatoren daarentegen maken geen deel uit van het reactiemengsel, maar vormen een aparte fase die in contact wordt gebracht met het reactiemengsel. Dit kan echter ook een poeder zijn dat in een vloeistof zweeft.
Homogene katalysator
bewerkenHomogene katalysatoren zijn katalysatoren die zich in dezelfde fase bevinden als de reactanten. Wanneer verwezen wordt naar homogene katalysatoren, wordt gewoonlijk geduid op metaalcomplexen die zijn opgelost in een vloeibaar mengsel waarin zich ook de reactanten bevinden (als oplosmiddel of opgelost daarin). De werking van deze metaalcomplexen kan worden beïnvloed door het aanpassen van de liganden die aan het metaalcentrum zijn gebonden.
Een voorbeeld hiervan is de ontbinding van mierenzuur, de ontledingsreactie wordt gekatalyseerd door geconcentreerd zwavelzuur.
Werking
bewerkenVoor- en nadelen
bewerkenEen belangrijk voordeel van een homogene katalysator is dat hij altijd goed in contact is met de reactanten. Daarentegen moet hij, als hergebruik van de katalysator gewenst is, later uit het uitgereageerde mengsel worden teruggewonnen.
Biologische katalysatoren
bewerkenIn de biologie zijn, in het cytosol opgeloste, katalysatoren de aanjagers voor alle biochemische reacties in de cellen, de stofwisseling, die het organisme doen groeien en in leven houden:
- mRNA en tRNA zijn bij de eiwitsynthese onmisbare katalysatoren. mRNA is de bouwtekening en tRNA beschrijft hoe de tekening moet worden gelezen.
- gespecialiseerde eiwitten fungeren als katalysator van uiteenlopende stofwisselings-processen: deze eiwitten noemt men enzymen en hormonen. Een voorbeeld is de biologische oxidatie ('verbranding') van organische verbindingen bij lichaamstemperatuur. Hoewel het energetisch gunstig is dat glucose reageert met zuurstof, gebeurt dit niet door een te hoge energiebarrière, de activeringsenergie. In het menselijk lichaam wordt deze barrière geslecht: de glucose wordt middels de celademhaling geoxideerd ('verbrand') bij 37°C, met behulp van biologische katalysatoren: enzymen.
Heterogene katalysator
bewerkenEen heterogene katalysator is een katalysator die zich in een andere fase bevindt dan de reactanten. De katalysator is dan een vaste stof, en de reactanten bestaan uit een vloeibaar of gasvormig mengsel. Heterogene katalyse wordt voornamelijk toegepast bij grootschalige chemische productieprocessen, zoals het Haber-Boschproces, de synthese van ammoniak uit waterstof- en stikstofgas, met vaste ijzerdeeltjes als katalysator. Uitlaatgassen van een benzine- of dieselmotor worden heterogeen-katalytisch gereinigd in de driewegkatalysator, onderdeel van het uitlaatsysteem.
Werking
bewerkenDoordat heterogene katalysatoren vaste stoffen zijn hebben ze, in tegenstelling tot homogene katalysatoren, een oppervlak. Het is (een deel van) dit oppervlak dat uiteindelijk de katalysator vormt, en niet een enkel individueel atoom of atoomcomplex. Eerst worden de reactanten geadsorbeerd aan het oppervlak, vervolgens vindt er een herrangschikking van de moleculaire banden plaats op dit oppervlak, en het product (de producten) verlaat (verlaten) uiteindelijk het oppervlak.
Voor- en nadelen
bewerkenHeterogene katalysatoren zijn, in tegenstelling tot homogene katalysatoren, zeer eenvoudig voor hergebruik terug te winnen, maar er is vaak veel onderzoek nodig om voldoende contact tussen de katalysator en het reactiemengsel ook op lange duur te garanderen.
Een heterogene katalysator is zeer geschikt voor een continu proces: hij kan stationair deel uitmaken van een reactieomgeving terwijl de reactanten en producten door de reactor stromen. Een voorbeeld hiervan is de katalysator die in auto's voor de reiniging van uitlaatgassen gebruikt wordt. Hier stroomt het uitlaatgas, dat voor een deel uit onverbrande koolwaterstoffen bestaat, door een keramisch blok met vele kanaaltjes die intern met een laagje platina en palladium bedekt zijn. Deze metalen dienen als katalysator die bij een werktemperatuur tussen 300 en 850 °C onverbrande brandstof en ongewenste producten als koolstofmonoxide oxideert tot koolstofdioxide, en stikstofoxiden reduceert tot distikstof en water. Toevoeging van tetra-ethyllood aan de brandstof verstoort de werking van de katalysator in ernstige mate. De gebruikelijke naam voor de uitlaatgasreinigende katalysator is de driewegkatalysator.
Werking van een katalysator
bewerkenDe aanwezigheid van een katalysator laat een reactie sneller verlopen. Toch wordt de concentratie, druk of temperatuur niet verhoogd. De werking valt te verklaren doordat een katalysator K de activeringsenergie Ea verlaagt door zelf met de reactie mee te doen. Na de reactie komt hij weer vrij. Als voorbeeld de reactie
Deze verloopt bij aanwezigheid van een katalysator K in meerdere stappen:
Opgeteld geeft dit:
K kan vervolgens links en rechts worden weggestreept.
Het is belangrijk om in te zien dat het energieverschil van de reactie zowel zonder als met katalysator gelijk is. Aangezien in een evenwichtsreactie de ligging van het evenwicht gebaseerd is op dit energieverschil kan een katalysator niet worden gebruikt om een evenwichtsreactie te laten aflopen naar één kant, maar alleen om sneller de evenwichtstoestand te bereiken.
Iets anders wordt het als er nog andere reacties mogelijk zijn, bijvoorbeeld A2 of B2 als producten. Als zo'n storende reactie een activeringsenergie heeft die lager ligt dan de gewenste reactie zonder katalysator, dan zullen er zonder katalysator bijna alleen nevenproducten worden gevormd, en met katalysator bijna alleen de gewenste producten. Op die manier kan een katalysator niet alleen de snelheid, maar ook de selectiviteit van een reactie beïnvloeden. Een katalysator hoeft echter niet per se een tussenproduct te vormen. Het kan ook gebeuren dat de aantrekkingskrachten tussen de atomen van de katalysator en die van het reagens ervoor zorgen dat de bindingen in het reagens worden verzwakt (soms zelfs verbroken). Dan ontstaan veel reactievere deeltjes. Een voorbeeld hiervan de adsorptie van waterstofgas door platina (of nikkel).
Negatieve katalyse
bewerkenNegatieve katalyse is een onjuiste term voor inhibitie (scheikunde). Negatieve katalyse zou betekenen dat de reactie een pad zou volgen met een grotere activeringsenergie. Dit is in strijd met de wetten van de thermodynamica.
Figuurlijk taalgebruik
bewerkenWanneer een plotselinge gebeurtenis een reeds lopend proces versnelt, kan deze als 'katalysator' worden aangeduid. De Augustusstaatsgreep in Moskou was in figuurlijke zin een katalysator voor het uiteenvallen van de Sovjet-Unie.