Trimethylaluminium
Trimethylaluminium (afgekort tot TMA) is een verbinding met de formule Al2(CH3)6, meestal korter geschreven als Al2Me6 of (AlMe3)2. Een betere naam voor de verbinding zou dus hexamethyldialuminaan zijn (zie verder onder: Structuur en binding). Deze pyrofore, kleurloze vloeistof is een industrieel belangrijke organoaluminiumverbinding. De verbinding geeft witte rook (aluminiumoxide) als het met lucht in aanraking komt.
| Trimethylaluminium | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
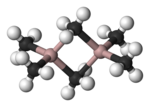
Molecuulmodel van trimethylaluminium
| ||||
| Algemeen | ||||
| Molecuulformule | (monomeer) C3H9Al (dimeer) C6H18Al2 | |||
| IUPAC-naam | trimethylalumaan | |||
| Andere namen | trimethylaluminium | |||
| Molmassa | 144,18 g/mol | |||
| SMILES | C[Al](C)C
| |||
| CAS-nummer | 75-24-1 | |||
| PubChem | 16682925 | |||
| Wikidata | Q416321 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H250 - H260 - H314 | |||
| EUH-zinnen | EUH014 | |||
| P-zinnen | P210 - P231+P232 - P280 - P305+P351+P338 - P370+P378 - P422 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,752 g/cm³ | |||
| Smeltpunt | 15 °C | |||
| Kookpunt | 125 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
bewerkenDe synthese van trimethylaluminium is een tweestapsproces dat zich als volgt laat samenvatten:
Trimethylaluminium is pyrofoor, een eigenschap die aparte veiligheidsproblemen oplevert bij de verwerking ervan. Om deze reden wordt het vaak gecomplexeerd met het tertiaire amine tri-ethyleendiamine (DABCO).[1]
Structuur en binding
bewerkenTrimethylaluminium vormt een dimeer, analoog in structuur en bindingstype aan diboraan. Net als in diboraan worden de twee aluminiumatomen via een 3-center-2-elektronbinding aan elkaar gekoppeld: de gedeelde methylgroepen vormen bruggen tussen de twee aluminiumatomen. De bindingslengte tussen een eindstandig koolstofatoom en aluminium bedraagt 197 pm, voor de afstand tussen de koolstofatomen en aluminium in de bruggen wordt 214 pm gevonden.[2] De koolstofatomen in de bruggen worden door vijf buuratomen omringd: drie waterstofatomen en twee aluminiumatomen. De methylgroepen verwisselen snel van plaats, zowel intramoleculair (binnen één molecule) als intermoleculair (tussen moleculen).
3-center-2-elektronbindingen zijn het kenmerk bij uitstek van elektrondeficiënte moleculen en deze stoffen hebben een sterke neiging tot reactie met Lewisbasen waardoor meer standaard 2-center-2-elektronbindingen ontstaan. Zo worden met amines adducten gevormd van het type R3N-AlMe3. Een andere reactie die leidt tot verbindingen die de octetregel wel volgen is de reactie van Al2Me6 met aluminiumchloride tot (AlMe2Cl)2.
Het monomeer, AlMe3, waarin een aluminiumatoom aan drie methylgroepen gebonden is niet bekend.
Toepassingen
bewerken- De voornaamste toepassing van trimethylaluminium is de productie van methylaluminoxaan (Al(CH3)O)n), een verbinding die gebruikt wordt in combinatie met Ziegler-Natta-katalysatoren bij de polymerisatie van alkenen.
- Het Tebbe-reagens, dat gebruikt wordt om esters en ketonen te methyleneren wordt uit trimethylaluminium gemaakt.
- Vanuit sondeerraketten wordt trimethylaluminium in de hogere lagen van de atmosfeer gebracht om daar windpatronen te onderzoeken. Het geeft witte rook als het aan de lucht wordt blootgesteld.
- In de productie van halfgeleiders wordt de stof gebruikt om dunne lagen diëlektricum zoals Al2O3 aan te brengen via processen als chemical vapor deposition of atomic layer deposition.
- In een reactie waarbij ook Cp2ZrCl2 aanwezig is, addeert (CH3)2Al-CH3 over de drievoudige binding in alkynen, waarbij vinyl-aluminiumverbindingen gevormd worden. Deze verbindingen worden vervolgens in de organische synthese ingezet bij reacties die bekendstaan als carboaluminering.[3]
Productie van halfgeleiders
bewerkenBij de productie van halfgeleiders worden hoge eisen gesteld aan de zuiverheid van de uitgangsstoffen. Trimethylaluminium dat voor dit doel wordt gebruikt wordt streng gecontroleerd op de aanwezigheid (of afwezigheid) van andere elementen, oxiden en organische stoffen. Het wordt bijvoorbeeld ingezet bij de productie van onder meer AlAs, AlN, AlP, AlSb, AlGaAs, AlInGaAs, AlInGaP, AlGaN, AlInGaN en AlInGaNP.
Externe link
bewerken- ↑ Biswas, K.; Prieto, O.; Goldsmith, P. J.Woodward, S. (2005). Remarkably Stable (Me3Al)2DABCO and Stereoselective Nickel-Catalyzed AlR3 (R = Me, Et) Additions to Aldehydes. Angewandte Chemie International Edition 44 (15): 2232–2234. PMID 15768433. DOI: 10.1002/anie.200462569.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001 ISBN 0-12-352651-5
- ↑ Negishi, E.; Matsushita, H.. Palladium-Catalyzed Synthesis of 1,4-Dienes by Allylation of Alkenyalane: α-Farnesene [1,3,6,10-Dodecatetraene, 3,7,11-trimethyl-]. J. Org. Chem..

