Luminol
Luminol is een organische verbinding die een bijzondere eigenschap heeft: bij oxidatie ervan komt energie vrij in de vorm van zichtbaar licht. Dit verschijnsel wordt chemoluminescentie genoemd. Het verschijnsel treedt op wanneer de binding tussen de twee stikstofatomen wordt geoxideerd tot twee carbonzuuramide-groepen. Dit komt doordat de elektronen in de stikstofatomen in excitatie geraken (aangeslagen toestand). Bij het terugvallen naar de grondtoestand worden fotonen uitgezonden met een golflengte die overeenkomt met het blauwe gedeelte van het zichtbare licht.
| Luminol | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
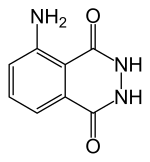
Structuurformule van luminol
| ||||

| ||||
| Algemeen | ||||
| Molecuulformule | C8H7N3O2 | |||
| IUPAC-naam | 5-amino-2,3-dihydro-1,4-ftaalazinedion | |||
| Andere namen | 3-aminoftaalhydrazide, 5-amino-2,3-dihydroftalazine-1,4-dion, 3-aminoftaalzuurhydrazide | |||
| Molmassa | 177,16 g/mol | |||
| SMILES | NC1=C(C(NNC2=O)=O)C2=CC=C1
| |||
| CAS-nummer | 521-31-3 | |||
| EG-nummer | 208-309-4 | |||
| Wikidata | Q408061 | |||
| Beschrijving | Geelgroen poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| LD50 (ratten) | (oraal) > 500 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | geel-groen | |||
| Smeltpunt | 319 °C | |||
| Oplosbaarheid in water | 1 g/L | |||
| Goed oplosbaar in | basen | |||
| Slecht oplosbaar in | water | |||
| log(Pow) | 0,740 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Luminol is een geelgroen poeder dat slecht oplosbaar is in water.
Synthese
bewerkenLuminol kan bereid worden uit 3-nitroftaalzuur en hydrazine, waarbij dan 3-nitroftaalhydrazide ontstaat. Bij reductie van de nitrogroep met natriumdithioniet ontstaat luminol.
Gebruik bij forensisch onderzoek
bewerkenBij forensisch onderzoek wordt luminol ook wel gebruikt als indicatieve methode om bloed aan te tonen. Luminol licht namelijk op als het in contact komt met bloed (chemoluminescentie). Luminol wordt het meest gebruikt door de politie op een plaats delict, om snel en relatief eenvoudig te kunnen zien of iets wel of geen bloed is.
Om luminol te gebruiken moet het worden opgelost. In deze oplossing moeten nog een paar andere stoffen zitten die zorgen voor de luminescentie, bijvoorbeeld: waterstofperoxide (H2O2), natriumhydroxide (NaOH) en natriumcarbonaat (Na2CO3). Eerst worden Na2CO3 en NaOH opgelost zodat er een basische oplossing ontstaat. Daarna wordt luminol toegevoegd, omdat het in een basisch milieu beter oplost. Vlak voor gebruik wordt sterk verdund waterstofperoxide aan de oplossing toegevoegd. Nu start de reactie, waarbij 3-aminoftalaat, stikstofgas en water worden gevormd en een blauw licht ontstaat. De reactie verloopt uiterst langzaam, maar kan worden versneld met Fe3+ als katalysator. De oplossing zal in een zeer korte tijd intenser oplichten, niet meer dan 1 seconde, de reactie zelf duurt ongeveer 1 minuut (afhankelijk van een aantal factoren). Aangezien hemoglobine in bloed ook Fe3+ bevat, is dit een methode om bloedsporen te detecteren.
Nadelen
bewerkenEr kleven echter ook nadelen aan luminol. Het is destructief voor het DNA in het bloed (door onderzoek en aanpassing begin 21e eeuw overigens inmiddels wel minder destructief) en er zijn ook andere stoffen dan bloed waarop luminol een positieve uitslag geeft:
- Micro-organismen (denk hierbij aan schimmels en bacteriën)
- Geoxideerde metalen
- Jodide- en hypochlorietionen, bijvoorbeeld in schoonmaakmiddelen
- Formaline (ook wel 'sterk water' genaamd)
- Enzymen (meer bepaald peroxidasen) aanwezig in planten, met name in citrusvruchten, bananen, watermeloen en talloze groentesoorten
- Een groot aantal verfsoorten.
De reactie met een andere stof dan bloed kan herkend worden aan een kortere luminescentie.
Om vast te stellen of het echt om bloed gaat, zijn er alternatieven. Een daarvan is een tetrabasetest. Of het bloed menselijk is moet dan nog worden vastgesteld. Dat gebeurt in een laboratorium, bijvoorbeeld bij het Nederlands Forensisch Instituut.
Demonstratieve experimenten
bewerkenDe reactie verloopt erg langdurig wanneer een spatelpunt luminol wordt opgelost in ongeveer 20 milliliter verdunde natronloog (een oplossing van NaOH). Aan het mengsel wordt vervolgens een spatelpunt natriumsulfiet, samen met een kleine hoeveelheid 3% waterstofperoxide, en als laatste een spatelpuntje natriumperoxodisulfaat toegevoegd. Roeren is nodig om de vaste stoffen te doen oplossen, na enkele seconden start de chemoluminescentiereactie welke vervolgens tientallen minuten relatief intens verloopt.
Ook kan waterstofperoxide in plaats van natriumperoxodisulfaat gebruikt worden, echter verloopt de reactie dan erg snel.
Externe link
bewerken- (en) MSDS van luminol
