Rhodizonzuur
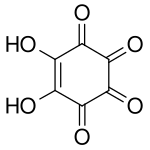
Rhodizonzuur is een chemische verbinding met de formule , of met iets meer nadruk op de structuur ervan: . Het kan beschouwd worden als het tweevoudig enol én het viervoudig keton van cyclohexeen, meer precies als: 5,6-dihydroxy-cyclohex-5-een-1,2,3,4-tetron.
| Rhodizonzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
Structuurformule van rhodizonzuur
| ||||

| ||||
Ruimtelijk model van rhodizonzuur
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Andere namen | dihydroxydiquinoyl dioxydiquinon | |||
| Molmassa | 170.20 g/mol | |||
| SMILES | C1(=C(C(=O)C(=O)C(=O)C1=O)O)O
| |||
| CAS-nummer | 118-76-3 | |||
| PubChem | 67050 | |||
| Wikidata | Q2823301 | |||
| Fysische eigenschappen | ||||
| Smeltpunt | 130 - 132 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Rhodizonzuur wordt meestal verkregen als dihydraat: . Zoals bij meer cyclische polyketonen wordt dit dihydraat beter beschreven als: 2,3,5,5,6,6-hexahydroxycyclohex-2-een-1,4-dion. Twee van de oorspronkelijke dubbelgebonden zuurstofatomen zijn vervangen door geminale hydroxylgroepen. Het oranje tot dieprode en zeer hygroscopische watervrije zuur wordt verkregen via sublimatie van het dihydraat bij lage druk.[1][2]
Zoals veel enolen, bijvoorbeeld vitamine C, staat rhodizonzuur makkelijk zijn protonen af: pKz1 = 4.378 ± 0.009, pKz2 = 4.652 ± 0.014 bij 25 °C),[3] waarbij achtereenvolgens , (waterstofrhodizinaat) en , rhodizinaat, ontstaan. Het laatste ion is aromatisch en symmetrisch. De dubbele binding en de negatieve ladingen zijn gedelocaliseerd en gelijkmatig over de 6 C=O - eenheden verdeeld. De kleuren van rhodizinaten lopen uiteen van van diverse tinten rood naar gelig en paars.
Rhodizonzuur is toegepast in herkenningsreacties voor barium, lood en andere metalen.[4] Vooral de natriumrhodizonaat-test wordt gebruikt om gunshot residuen, die lood bevatten, te detecteren op het lichaam of de kleding van het slachtoffer of de verdachte[5] en onderscheid te maken tussen wonden veroorzaakt door kogels enerzijds en pijlen anderzijds. Dit laatste kan een rol spelen bij de handhaving van jachtreglementen.[6]
Geschiedenis bewerken
Rhodizonzuur werd ontdekt door de Australische chemicus Johann Heller in 1837 als een van de reactieproducten die ontstonden bij het verhitten van kaliumcarbonaat en houtskool.[7][8][9] De naam is afgeleid van het Grieks: ῥοδίζω (rhodizō, "rood kleuren"),[10] naar aanleiding van de kleur van de zouten.
Chemie bewerken
Zouten bewerken
De rhodizonaten vertonen met doorvallend licht roodachtige kleuren, van gelig oranje tot paars. In gereflecteerd licht krijgen ze vaak een groenige glans.
Kaliumrhodizonaat wordt onder andere in een goede opbrengst en zuiverheid verkregen via de oxidatie van inositol met salpeterzuur, gevolgd door behandeling van het reactieproduct met kaliumacetaat in aanwezigheid van zuurstof. Het gevormde rhodizonaat kristalliseert uit ten gevolge van de lage oplosbaarheid ervan in water.[11]
Natriumrhodizonaat is een donkerbruine, vaste stof. Bij afwezigheid van vocht is de stof stabiel,[12] maar een waterige oplossing ontleedt in een paar dagen, zelfs in de koelkast.[4]
Lood(II)rhodizonaat is een donker violette, vaste stof.[12][13]
Lithiumrhodizonaat, , is stabiel tot ongeveer 400 °C, dan ontleed het naar en cyclohexaanhexon. De laatste stof is bij die temperatuur niet stabiel en gaat over in een mengsel van koolstofmonoxide, koolstofdioxide en koolstof.[14]
Oxidatie en ontleding bewerken
Rhodizonzuur is een van de oxidatiestappen in de serie van benzeenhexol naar cyclohexaanhexon.[4]
| Benzeenhexol | Tetrahydroxy- 1,4-benzochinon THBQ |
Rhodizonzuur | Cyclohexaanhexon |
Lithiumrhodizonaat, in combinatie met de zouten van THBQ en benzeenhexol, wordt onderzocht op toepasbaarheid in oplaadbare batterijen.[14]
Het monovalente anion is gedetecteerd in de massaspectrograaf.[15]
Rhodizonzuur, evenals het rhodizonaat-anion, kan een van de CO-eenheden afsplitsen, waarbij croconzuur of croconaat ontstaan, respectievelijk en . Het mechanisme van deze reacties wordt niet helemaal begrepen (1999).
In basische oplossingen (pH > 10) wordt rhodizonzuur snel omgezet. Bij afwezigheid van zuurstof ontstaat het THBQ-anion, in aanwezigheid van zuurstof is croconaat het product.
zuurstofvrij: rhodizonaat THBQ-anion met zuurstof: rhodizonaat croconaat
Bij pH = 8,3 en blootstelling aan licht zijn oplossingen, mits zuurstofvrij, dagenlang stabiel. In aanwezigheid van zuurstof treedt ontleding op naar croconzuur en andere producten (mogelijk cyclohexaanhexon of dodecahydroxycyclohexaan.[16][17]
Structuur bewerken
Zuur bewerken
In oplossingen zijn rhodizonzuur en het mono-anion vooral gehydrateerd aanwezig, waarbij een of meer van de carbonylgroepen vervangen zijn door geminale hydroxylgroepen.[3]
Zouten bewerken
In watervrij rubidiumrhodizonaat, , zijn de anionen en de rubidiumionen gestapeld in parallelle kolommen. In het vlak haaks op de assen van de kolommen bestaat het rooster uit twee in elkaar geschoven hexagonale rasters. De anionen zijn vlak.[2]
Watervrij kaliumrhodizonaat, , heeft een iets andere bouw: de anionen en kathionen liggen in verschillende, parallelle vlakken. De anionen vormen nog steeds een hexagonaal rooster. Elk kalium-ion is met symmetrisch door acht zuurstof-atomen omringd, afkomstig van vier rhodizonaat-ionen. Deze vier anionen zijn afkomstig van twee verschillende vlakken met anionen. De anionen zijn een beetje gedraaid in de zodat de ringen een beetje op de bootconformatie van cyclohexaan lijken, met een afwijking van het vlak van 10,8 pm.[18]
Natriumrhodizonaat, , heeft een met het kaliumzout vergelijkbare structuur, alleen is de afwijking uit het platte vlak iets groter: 11,3 pm.[19]
In oplossing zijn de rhodizonaat-anionen niet gehydrateerd.[3]
Bronnen, noten en/of referenties
|




