Hydroxylamine
Hydroxylamine is een reactieve anorganische verbinding met als brutoformule NH2OH. In zuivere toestand is het bij kamertemperatuur een witte kristallijne, sterk hygroscopische vaste stof. Hydroxylamine wordt meestal verhandeld en gebruikt in waterige oplossing. Het is een onstabiele verbinding, die bij verwarming explosief ontleedt.
| Hydroxylamine | |||||||
|---|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||||

| |||||||
Structuurformule van hydroxylamine
| |||||||
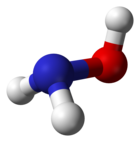
| |||||||
Molecuulmodel van hydroxylamine
| |||||||
| Algemeen | |||||||
| Molecuulformule | NH2OH | ||||||
| IUPAC-naam | hydroxylamine | ||||||
| Molmassa | 33,03 g/mol | ||||||
| SMILES | NO
| ||||||
| CAS-nummer | 7803-49-8 | ||||||
| EG-nummer | 232-259-2 | ||||||
| PubChem | 787 | ||||||
| Wikidata | Q259997 | ||||||
| Waarschuwingen en veiligheidsmaatregelen | |||||||
| |||||||
| H-zinnen | H200 - H290 - H302 - H373 - H335 - H315 - H318 - H317 - H400 | ||||||
| EUH-zinnen | geen | ||||||
| P-zinnen | P273 - P280 - P305+P351+P338 - P501 | ||||||
| Hygroscopisch? | ja | ||||||
| EG-Index-nummer | 612-122-00-7 | ||||||
| Fysische eigenschappen | |||||||
| Aggregatietoestand | vast | ||||||
| Kleur | kleurloos | ||||||
| Dichtheid | 1,21 g/cm³ | ||||||
| Smeltpunt | 33 °C | ||||||
| Goed oplosbaar in | koud water | ||||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||||
| |||||||
Synthese bewerken
Hydroxylamine wordt verkregen door de reductie van hogere oxidatietoestanden van stikstof (zoals stikstofmonoxide, nitriet en nitraat), met behulp van waterstofgas, zwaveligzuur of elektrische stroom.
Voor de reductie met behulp van waterstofgas is een katalysator nodig, meestal palladium op koolstof of platina op koolstof. Met stikstofmonoxide treedt volgende reactie op:
Men kan ook vertrekken van salpeterzuur (HNO3).[1] Deze reductie, in een 50%-oplossing van zwavelzuur, met behulp van elektrische stroom gebeurt volgens de vergelijking:
Een andere mogelijkheid is de reactie van ammoniumnitriet met zwaveldioxide.
Toepassingen bewerken
Hydroxylamine is een belangrijke grondstof voor de productie van nylon. De reactie van hydroxylamine met cyclohexanon vormt cyclohexanonoxime, dat dan via de Beckmann-omlegging omgezet wordt in caprolactam (hexanolactam), de grondstof voor nylon 6.
In de elektronicaindustrie gebruikt men ultrazuiver hydroxylamine in resist stripper om fotoresist te verwijderen die voor fotolithografie is aangebracht.
Toxicologie en veiligheid bewerken
Hydroxylamine is een zeer reactieve, instabiele stof en kan bij verwarming ontleden. Deze ontleding , waarbij de gassen ammoniak, stikstof en waterdamp ontstaan, kan explosief zijn:
Om die reden wordt hydroxylamine doorgaans geproduceerd als een zout, zoals hydroxylammoniumchloride, hydroxylammoniumsulfaat of hydroxylammoniumfosfaat.
Hydroxylamine is irriterend voor de huid en de luchtwegen, en corrosief voor de ogen. De stof kan effecten hebben op het bloed, met als gevolg de vorming van methemoglobine (een vorm van hemoglobine die geen zuurstof kan transporteren) en, bij langdurige blootstelling, op termijn ook bloedarmoede.
De stof is zeer giftig voor waterorganismen.
Ongevallen bewerken
- Op 19 februari 1999 ontplofte een vat met hydroxylamine in de fabriek van Concept Sciences nabij Allentown (Pennsylvania).[2] Hierbij vielen vijf doden en zes gewonden.
- Op 10 juni 2000 was er een ontploffing in een destillatietoren van hydroxylamine in de fabriek van Nissin Chemical in Japan, met vier doden en 28 gewonden tot gevolg.
Door deze explosie bleef BASF tijdelijk over als de enige producent van zuiver hydroxylamine voor de elektronica-industrie. BASF produceert hydroxylamine in haar fabriek te Ludwigshafen, Antwerpen en Freeport.[3] Nissin Chemical bouwde later een nieuwe, kleinere productie-eenheid en Honeywell begon in 2002 ook met de productie van hoogzuiver hydroxylamine.[4]
Externe links bewerken
- hydroxylamine - International Chemical Safety Card
- (en) MSDS van hydroxylamine (50% waterige oplossing)[dode link]
Bronnen, noten en/of referenties
|




