Dehydroalanine
Dehydroalanine (DHA) is een niet-proteïnogeen en ongebruikelijk onverzadigd aminozuur dat voorkomt in eiwitten van microbiologische oorsprong. Ook gebruikte namen voor DHA zijn: α,β-didehydroalanine, (alpha)-(beta)-di-dehydroalanine of 2,3-didehydroalanine. Veel peptides die DHA bevatten hebben toxische en/of antibiotische eigenschappen zoals antibiotica of microcystines.
| Dehydroalanine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
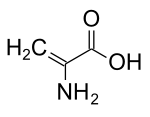
| ||||
Structuurformule van dehydroalanine
| ||||
| Algemeen | ||||
| Molecuulformule | C3H5NO2 | |||
| IUPAC-naam | 2-aminoprop-2-eenzuur | |||
| Andere namen | 2-aminoacrylzuur | |||
| Molmassa | 87,08 g/mol | |||
| SMILES | C=C(C(=O)O)N
| |||
| CAS-nummer | 1948-56-7 | |||
| PubChem | 123991 | |||
| Wikidata | Q1183089 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,222 g/cm³ | |||
| Kookpunt | 251,2 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Dehydroalanine is als primair enamine niet stabiel en legt om naar het stabielere tautomeer 2-iminopropaanzuur.
Er zijn twee enzymen bekend met dit aminozuur. In beide gevallen is serine het proteïnogene aminozuur dat in een posttranslationele modificatie in DHA wordt omgezet:[1]
- fenylalanine-ammoniak-lyase in planten en schimmels
- histidase in diverse organismen
Dehydroalanine komt ook in voedingsstoffen als caseïne voor. Deze voedingsstoffen hebben dan vaak een basische behandeling ondergaan, bijvoorbeeld met natriumhydroxide. Onder die omstandigheden kan serine gedehydrateerd worden tot dehydroalanine. Bij de bereiding van tofoe is dit standaard het geval.
Na vorming is dehydroalanine in voedsel niet stabiel, vaak treedt reactie op met lysine, waarbij een crosslinkend aminozuur, lysinoalanine (LAL) ontstaat. Lysinoalanine is eveneens een niet-proteïnogeen en ongebruikelijk aminozuur. LAL is aangetoond zowel in thuis bereid voedsel als in commerciële producten. Hoewel het ontstaan van lysinoalanine via dehydroalanine bij koken onder basische omstandigheden goed begrepen wordt, kan het ook ontstaan wanneer gekookt wordt zonder dat sprake is van basische omstandigheden.
- ↑ [1] , bezocht op 20 mei 2015 -->. Phenylalanine and histidine ammonia-lyases active site Ed.: Swiss Institute Bioinformatics Internetpagina: DHA in actief centrum enzym geraadpleegd op 20 mei 2015