Natriumcitraat
Met natriumcitraat wordt gewoonlijk trinatriumcitraat bedoeld, een van de drie natriumzouten van citroenzuur:
- mononatriumcitraat: NaH2(C3H5O(COO)3)
- dinatriumcitraat: Na2H(C3H5O(COO)3)
- trinatriumcitraat: Na3C3H5O(COO)3
| Natriumcitraat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
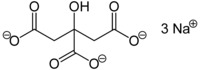
| ||||
Structuurformule van natriumcitraat
| ||||

| ||||
Kristallen van natriumcitraat
| ||||
| Algemeen | ||||
| Molecuulformule | C6H5Na3O7 | |||
| IUPAC-naam | trinatrium-2-hydroxypropaan-1,2,3-tricarboxylaat | |||
| Molmassa | 258,07 g/mol | |||
| SMILES | C(C(=O)[O-])C(CC(=O)[O-])(C(=O)[O-])O.[Na+].[Na+].[Na+]
| |||
| CAS-nummer | 68-04-2 | |||
| PubChem | 6224 | |||
| Wikidata | Q102349762 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit-kleurloos | |||
| Dichtheid | (bij 18°C) 1,76 g/cm³ | |||
| Smeltpunt | > 300 °C | |||
| Oplosbaarheid in water | ca. 425 g/L | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Alle drie zijn ze in de Europese Unie toegelaten als voedingsadditief met als functie zuurteregelaar (voedingszuur). Het E-nummer is E331 (respectievelijk E331(i), E331(ii) en E331(iii)).
Synthese
bewerkenNatriumcitraat wordt bereid door de neutralisatie van citroenzuur met natronloog.
Toepassingen
bewerkenMononatriumcitraat is, net als citroenzuur, een hulpstof in bruistabletten, in combinatie met bicarbonaat. In water reageren deze en komt er koolstofdioxidegas vrij.
Dinatriumcitraat wordt gebruikt als antioxidant in voeding, evenals om het effect van andere antioxidanten te versterken of verbeteren.[1]
Trinatriumcitraat wordt ook gebruikt als anticoagulans en verhindert het vroegtijdig stollen van bloed of bloedplasma bij het transport naar het laboratorium of bij aferese.
Inname van een natriumcitraatoplossing kort vóór een wedstrijd blijkt de prestaties te bevorderen van langeafstandslopers.[2][3][4] Het heeft wel onaangename neveneffecten op het maag- en darmstelsel.
Natriumcitraat wordt verder onder andere gebruikt als smeltzout om harde kaas zachter te maken.
- ↑ Alkarate from Macleods: Disodium Hydrogen Citrate. drugsupdate.com. Gearchiveerd op 25 juli 2020. Geraadpleegd op 26 februari 2017.
- ↑ Natriumcitraat maakt duursporters sneller. Ergogenics 05/02/2004
- ↑ R. Shave et al. The effects of sodium citrate ingestion on 3,000-meter time-trial performance. J. Strength Cond. Res. Vol. 15 (2001), blz. 230-4. PMID 11710409
- ↑ V. Oöpik et al. Effects of sodium citrate ingestion before exercise on endurance performance in well trained college runners. Br. J. Sports Med. Vol. 37 (2003), blz. 485-9. PMID 14665584