Disulfaan
Diwaterstofdisulfide is een anorganische verbinding met de formule . Deze waterstofverbinding uit de zuurstofgroep is een bleekgele, vluchtige vloeistof met een kamfer-achtige geur. De verbinding ontleedt makkelijk in waterstofsulfide en elementaire zwavel.[3]
| Waterstofdisulfide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Afstanden: H-S: 135 pm; S-S: 206 pm
| ||||
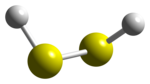
| ||||
■ Zwavel, S ■ Waterstof, H | ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Diwaterstofdisulfide | |||
| Andere namen | Disulfaan, Waterstofpersulfide, Thiosulfeenzuur | |||
| Molmassa | 66,14 g/mol | |||
| SMILES | SS
| |||
| InChI | 1/H2S2/c1-2/h1-2H
| |||
| CAS-nummer | 13465-07-1 | |||
| PubChem | 108196 | |||
| Wikidata | Q2669545 | |||
| Beschrijving | Bleekgele vloeistof[1] | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,334 g/cm³[1] | |||
| Smeltpunt | −89,6 °C[1] | |||
| Kookpunt | 70,7 °C[1] | |||
| Goed oplosbaar in | Koolstofdisulfide, Benzeen, Tetrachloormethaan.[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Structuur
bewerkenDe verbindingen tussen de atomen in kan geschreven worden als . Daarmee is de structuur van het molecuul goed vergelijkbaar met die van waterstofperoxide. Beide moleculen zijn duidelijk niet vlak en hebben symmetrie C2. De tweevlakshoek tussen en is 90,6°. Dit is veel minder dan de 111,5° die voor gevonden wordt. De bindingshoek is 92°, heel dicht bij de 90° van ongehybridiseerde divalente zwavel.[3]
Synthese
bewerkenDiwaterstofdisulfide kan gesynthetiseerd worden door het kraken van polysulfanen volgens de vergelijking:
De voornaamste verontreiniging die hierbij ontstaat is trisulfaan . Het benodigde polysulfaan wordt gemaakt in de reactie van zoutzuur met een oplossing van een nattriumpolysulfide in water. Het polysulfaan scheidt zich als een olie (zwaarder dan water) af uit het reactiemedium.
Reacties
bewerkenBij contact met water of alcoholen ontleed snel en onder milde condities tot waterstofsulfide en elementaire zwavel.
is zuurder dan , hoewel er geen waarde voor Kz of pKz genoemd worden in de literatuur.[3]
In de organische chemie addeert waterstofdisulfide aan alkenenwaarbij disulfides en thiolen ontstaan.[4]
Quantumtunneling en onderdrukking daarvan in dideuteriumdisulfide
bewerkenKijkend langs de as van de zwavel-zwavelbinding maken bindingen naar de waterstofatomen een hoek van ongeveer 90° met elkaar. Het achterste waterstofatoom kan echter met de klok mee verdraaid zijn, of juist ertegenin. De verbinding vertoont zodoende chiraliteit. Het is een van de lichtste chirale moleculen. Hoewel de structuur dus een duidelijk chirale component heeft, treedt interconversie (tunneling) tussen de twee vormen zeer makkelijk op. Dit gebeurt minder snel als beide waterstofatomen worden vervangen door het zwaardere deuterium: bij een geïsoleerd dideuteriumdisulfide-molecuul treedt bij een temperatuur van circa 10 K de wisseling tussen beide vormen op met een periode van ongeveer 5,6 ms.[5] Door het toevoegen van een klein beetje inert heliumgas wordt de chirale toestand van het molecuul tijdens botsingen gestabiliseerd, en daarmee het tunnelen naar de andere stand geblokkeerd.[6] Dit maakt deuteriumsulfide gedoteerd met helium een geschikte kandidaat voor onderzoek naar het Kwantum Zeno-effect.
Gezondheid
bewerkenkan in hoge concentraties duizeligheid veroorzaken, desoriëntatie en bij hogere concentraties bewusteloosheid.[7]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Hydrogen disulfide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Historische literatuur
- Walton, James H.; Parsons, Llewellyn B. (1 december 1921). Preparation and Properties of the Persulfides of Hydrogen. J. Am. Chem. Soc. 43 (12): 2539–48. DOI: 10.1021/ja01445a008.
- Georg Brauer: Handbook of Preparative Inorganic Chemistry Volume I, page 391, Wiley, 1963.
- von Richter, Victor: Translated by Edgar F Smith, "A Text-Book of Inorganic Chemistry", Page 111, P. Blakiston, Son & Co., 1893
Verwijzingen in de tekst
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 364.
- ↑ Ralf Steudel (2003). Elemental Sulfur and Sulfur-Rich Compounds II. Springer, pp. 107. ISBN 354040378-7.
- ↑ a b c R. Steudel "Inorganic Polysulfanes with n > 1" in Elemental Sulfur and Sulfur-Rich Compounds II (Topics in Current Chemistry) 2003, Volume 231, pp 99–125. DOI:10.1007/b13182
- ↑ Hazardous Reagents, Robinson Brothers
- ↑ Trost, J.; Hornberger, K. (2009). Hund's Paradox and the Collisional Stabilization of Chiral Molecules. Phys. Rev. Lett. 103 (2): 023202. PMID: 19659202. DOI: 10.1103/PhysRevLett.103.023202.
- ↑ Month-long calculation solves 82-year-old quantum paradox, Physics Today, September 2009, p. 16
- ↑ Stein, Wilkinson, G (2007). Seminars in general adult psychiatry. Royal College of Psychiatrists. ISBN 978-1-904671-44-2.
