Deltazuur
Deltazuur, of dihydroxycyclopropenon is een organische verbinding met de formule . Het kan beschouwd wordenals een keton en tweevoudig alcohol van cyclopropeen. Bij kamertemperatuur is het een stabiele, witte, vaste stof, oplosbaar in ether. Tussen 140 °C en 180 °C ontleed de stof, soms explosief. Hij reageert langzaam met water.[1]
| Deltazuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
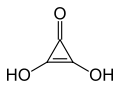
| ||||
Structuurformule van deltazuur
| ||||

| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Molmassa | 86.05 g/mol | |||
| SMILES | O=C1C(O)=C1O
| |||
| CAS-nummer | 54826-91-4 | |||
| PubChem | 11679790 | |||
| Wikidata | Q2823256 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Evenwichtsconstante(n) | pKz1 = 2,57 pKz2 = 6,03 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
De synthese van deltazuur is voor het eerst beschreven in 1975.[2]
Derivaten
bewerkenDeltaat
bewerkenDeltazuur wordt als zuur benoemd omdat het een zeer zuur eendiol is: de hydroxylgroepen verliezen heel makkelijk hun H+-ionen: pKz1 = 2.57, pKz2 = 6.03. Daarmee is dit zuur vergelijkbaar met fosforzuur in zijn eerste twee ionisatiestappen. Het resultaat van het protonverlies is een symmetrisch deltaat-ion, . De lading is gelijkmatig over de drie zuurstofatomen verdeeld, elk met een volwaardige negatieve lading. De drie koolstof-atomen vormen een aromatische ring[1] met twee elektronen en eenwaardig positief. De totale lading van het deltaat ion blijft daarmee tweewaardig negatief. Net als de andere cyclische di-anionen met de formule heeft het deltaat-ion een uitgesproken aromatisch karakter.[1]
De eerste beschreven zouten, deltaten, lithium- en kaliumdeltaat dateren van 1976. Het lithiumzout, is een witte, wateroplosbare vaste stof.[1]
Analoga
bewerkenDoor vervanging van de drie zuurstof-atomen in deltazuur ontstaan analoga.
Cyaanamide
bewerkenVervanging van de zuurtof-atomen door Cyaanamide-groepen, geeft het symmetrische anion .[3]
Dicyanomethyleen
bewerkenVervanging van de zuurstof-atomen door dicyanomethyleen-groepen, , levert een sterke oxidator op die makkelijke zowel eenwaardige stabiele radicaal-anionen oplevert als tweewaardige anionen.[4]
Synthese
bewerkenDe eerste synthese van deltazuur verliep via de fotolyse van de di-ester bis(trimthylsilyl)sqaraat, , die door verlies van een -groep overging in bis(trimthylsilyl)deltaat. Ontleding van de ester in butanol leidde tot deltazuur.[2]
Een tweede syntheseroute verloopt via de reactie van zilversquaraat met trimethylsilylchloride.[1][5]
Een meer recente synthese maakt gebruik van een uranium-complex in pentaan waarmee onder milde omstandigheden een cyclotrimerisatie mogelijk is van koolstofmonoxide. Het resultaat is een deltaat-ion, gebonden aan twee uranium-atomen.[6]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Deltic acid op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Verwijzingen in de tekst
- ↑ a b c d e Eggerding, David, West, Robert (1976). Synthesis and properties of deltic acid (dihydroxycyclopropenone) and the deltate ion. Journal of the American Chemical Society 98. DOI: 10.1021/ja00428a043.
- ↑ a b Eggerding, David, West, Robert (1975). Synthesis of dihydroxycyclopropenone (deltic acid). Journal of the American Chemical Society 97 (1). DOI: 10.1021/ja00834a047.
- ↑ Beck, Johannes, Krieger-Beck, Petra (2006). Crystal structure of 1,2-bis(cyanoimino)-3-triethylammonio-cyclopropenylide. Analytical Sciences 22. DOI: 10.2116/analscix.22.x239.
- ↑ Fukunaga, T. (1976). Negatively substituted trimethylenecyclopropane dianions. Journal of the American Chemical Society 98 (2).
- ↑ Reetz, M. T., Neumeier, G., Kaschube, M. (1975). Thermische Umlagerung von Quadratsäure-Bis(trimethylsilyl)ester. Tetrahedron Letters 16. DOI: 10.1016/S0040-4039(00)72653-0.
- ↑ Summerscales, O. T., Cloke, F. G. N., Hitchcock, P. B., N. Hazari, J. C. Green (2006). Reductive cyclotrimerization of carbon monoxide to the deltate dianion by an organometallic uranium complex. Science 311 (5762). DOI: 10.1126/science.1121784.
