Thio-ureum
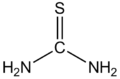
Thio-ureum is een organische verbinding bestaande uit koolstof, stikstof, zwavel en waterstof, met als brutoformule CH4N2S (of (NH2)2CS, waarmee de structuur beter wordt weergegeven).
| Thio-ureum | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
Structuurformule van thio-ureum
| |||||
| Algemeen | |||||
| Molecuulformule | CH4N2S | ||||
| IUPAC-naam | thio-ureum | ||||
| Andere namen | thiocarbamide | ||||
| Molmassa | 76,12 g/mol | ||||
| SMILES | C(=S)(N)N
| ||||
| CAS-nummer | 62-56-6 | ||||
| PubChem | 2723790 | ||||
| Wikidata | Q528995 | ||||
| Vergelijkbaar met | ureum | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H351 - H411 - H361d | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 - P280 | ||||
| Carcinogeen | ja | ||||
| EG-Index-nummer | 612-082-00-0 | ||||
| VN-nummer | 2811 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 1,405 g/cm³ | ||||
| Smeltpunt | 182 °C | ||||
| Matig oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
De verbinding lijkt qua structuur veel op ureum, met het belangrijke verschil dat het zuurstofatoom in ureum vervangen is door een zwavelatoom (vandaar het voorvoegsel thio- in de naam). De verschillen in eigenschappen tussen ureum en thio-ureum zijn gering en kunnen grotendeels worden verklaard uit het verschil in elektronegativiteit tussen het zuurstof- en het zwavelatoom. Thio-ureum is een veelgebruikt reagens in de organische synthese. Een belangrijke toepassing van thio-ureum is het gebruik in de synthese van pyrimidines, die op hun beurt worden gebruikt als bouwstenen voor herbicides, fungicides en insecticides, maar ook in de synthese van medicijnen. Deze pyrimidines kunnen gesynthetiseerd worden door thio-ureum te condenseren met β-dicarbonyl-verbindingen.
De naam "thio-ureum" verwijst ook naar de groep verbindingen met als algemene structuur (R1R2N)(R3R4N)C=S. Als groep zijn de thio-ureumverbindingen verwant aan de thioamiden, bijvoorbeeld RC(S)NR2, waarin R een organische groep is, bijvoorbeeld methyl of ethyl. De twee R-groepen hoeven niet gelijk te zijn en kunnen zelfs tot een ring aan elkaar gekoppeld zijn.
Structuur en binding bewerken
Thio-ureum is een vlak molecuul. De bindingsafstand voor de C=S-binding is voor een groot aantal, onderling ook sterk verschillende, derivaten bijna constant: 160±10 pm. Deze kleine spreiding geeft aan dat de C=S-binding nauwelijks betrokken is bij andere structuurelementen in het molecuul.
Thio-ureum komt voor in twee tautomere vormen:
| Thio-ureum | Isothio-ureum |
Synthese van thio-ureum bewerken
Wereldwijd ligt de jaarproductie van thio-ureum op ongeveer 10.000 ton. Ongeveer 40% daarvan wordt in Duitsland gemaakt, nog eens 40% in China. De resterende 20% wordt in Japan gemaakt. Thio-ureum kan gemaakt worden uit ammoniumthiocyanaat, daarmee is de synthese van de stof vergelijkbaar met die van ureum door Wöhler. De industriële synthese verloopt via de reactie van waterstofsulfide met calciumcyaanamide onder koolstofdioxide.[bron?]
Er zijn vele toepassingen voor thio-ureum en zijn derivaten. N,N-ongesubstitueerde thio-ureumderivaten worden doorgaans bereid door reactie van het corresponderende cyanamide met LiAlHSH met 1 mol.l−1 HCl in watervrije ether. LiAlHSH wordt gemaakt via een reactie tussen zwavel en LiAlH4.[bron?]
Toepassingen van thio-ureum bewerken
Peroxiden kunnen met behulp van thio-ureum tot de overeenkomstige diolen gereduceerd worden.[1] Het intermediair in deze synthese is het instabiele epidioxide. Alleen bij −100 °C is deze tussenstof aantoonbaar. Een epidioxide lijkt veel op een epoxide maar bevat twee zuurstofatomen in de brug in plaats van één zuurstofatoom. Het epidioxide wordt door thio-ureum tot diol gereduceerd.
Het reducerend vermogen van thio-ureum wordt ook toegepast na ozonolyse. In het reducerend vervolg op de ozonolyse ontstaan carbonylverbindingen.[2] Dimethylsulfide is op zich genomen ook een goed reagens voor deze reactie, maar aan dit reagens zit "een luchtje" wat in combinatie met de hoge vluchtigheid (b.p. 37 °C) de balans snel doet doorslaan naar thio-ureum, een verbinding die reukloze is en niet vluchtig (ten gevolge van zijn polariteit).
Thio-ureum wordt veel toegepast in de omzetting van alkylhalides in thiolen. Deze reactie verloopt via een isothiuroniumzout.[3] De reactie verloopt dankzij het gemak waarmee zwavel nucleofiele reacties aangaat en instabiliteit tegen hydrolyse van het gevormde isothiuroniumzout:
In principe kunnen ook alkalisulfiden (natrium- en kaliumsulfide) gebruikt worden om alkylhalogenides om te zetten in thiolen, maar een voordeel van de reactie van thio-ureum is dat geen dialkylsulfiden worden gevormd, die tot scheidingsproblemen leiden.
Thio-ureumderivaten worden als bouwstenen gebruikt in de synthese van pyrimidines. Zo worden thio-ureumverbindingen met β-dicarbonylverbindingen omgezet naar pyrimidines.[4] De aminogroep in het thio-ureum reageert eerst met een van de carbonylgroepen, waarna ringsluiting en tautomerisatie de reactie afmaken. Na ontzwavelen ontstaat het pyrimidine.
Op gelijksoortige wijze worden aminothiazolen uit alfa-halo-ketonen en thio-ureum gemaakt.[5]
Thio-ureum wordt gebruikt in de productie van vlamvertragende kunstharsen en versnellers van het vulkanisatieproces. Thio-ureum wordt als toevoeging bij diazopapier gebruikt (lichtgevoelig fotokopieerpapier). Het vloeibare schoonmaakmiddel TarnX voor zilver is in principe een oplossing van thio-ureum. Een vervanger van cyanide in het uitloogproces van zilver en goud kan verkregen worden via selectieve oxidatie van thio-ureum, waarbij ook het smelten van het metaal achterwege kan blijven.[6]
Veiligheid bewerken
Thio-ureum wordt als mogelijk kankerverwekkend en mutageen voor mensen beschouwd.[7]
Onderzoeken geven aan dat blootstelling aan thio-ureum kan leiden tot vergroting van de schildklier. In ratten is de relatie aangetoond tussen chronische blootstelling en tumoren in de lever. Mogelijk zijn er ook gevolgen voor het beenmerg.
De stof mag in Groot-Brittannië niet meer als gewasbeschermingsmiddel gebruikt worden.[8]
Literatuur bewerken
- The Chemistry of double-bonded functional groups edited by S. Patai. pp 1355–1496. John Wiley & Sons. New York, NY, 1977. ISBN 0-471-92493-8.


