Subschil
Een elektronensubschil of onderschil is de benaming voor een aspect van de elektronenconfiguratie van een atoom zoals dat door het nevenkwantumgetal bepaald wordt.
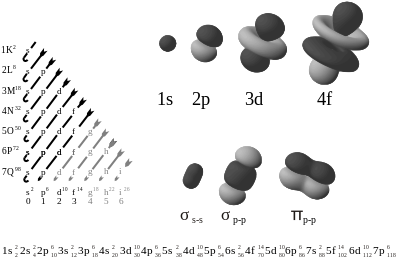
De verdeling van de elektronen rond een atoom wordt bepaald door vier kwantumgetallen:
- het hoofdkwantumgetal n, een hoofdverdeling van de energieniveaus, de (hoofd)schillen genoemd.
- het nevenkwantumgetal l (kleine L), verdeelt de (hoofd)schillen in subschillen. De subschillen worden aangegeven door een letter uit de reeks s, p, d, f, g, h, i, j, k, ... toe te voegen aan het hoofdkwantumgetal n. Voor een hoofdkwantumgetal n kan l de waarden 0, 1, 2, .., n – 1 bezitten. De letters s, p, d en f zijn ontleend aan de benamingen voor de lijnenseries uit de spectraalanalyse, s stond voor "scherp", p voor "principaal", d voor "diffuus" en f voor "fundamenteel".[1]
- het magnetische kwantumgetal m, verdeelt iedere subschil in 2 · l + 1 banen, m loopt van – l tot + l. In deze formule is l, het nevenkwantumgetal 0 tot 7, een kleine letter L.
- Ten slotte is er nog het spinkwantumgetal s van het elektron zelf, naast deze drie baan-kwantumgetallen. Dit getal is s = ½ en heeft een magnetisch spinkwantumgetal met twee waarden: – ½ en + ½ (spin up en spin down)
Bronnen, noten en/of referenties
|