Claisen-condensatie
De Claisen-condensatie is een chemische reactie waarbij een koolstof-koolstofbinding wordt gevormd, waarbij een reactie plaatsvindt tussen twee esters of een ester en een verbinding met een carbonyl-functionaliteit. Bij de reactie, die plaatsvindt door de toevoeging van een sterke base, wordt een β-keto-ester of een β-diketon gevormd. De reactie is vernoemd naar Rainer Ludwig Claisen, die voor het eerst onderzoek naar deze reactie publiceerde in 1881.
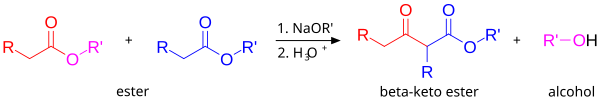
Reactieomstandigheden bewerken
Ten minste een van de reactanten moet een enoliseerbare functionaliteit bezitten, dat wil zeggen de verbinding moet een α-proton hebben (een proton direct naast de carbonylgroep) en bovendien moet het mogelijk zijn om een enolaat te vormen van de verbinding. Er zijn een aantal combinaties mogelijk van enoliseerbare en niet-enoliseerbare ketoverbindingen, waarbij de Claisen-condensatie toegepast kan worden.
Types bewerken
De klassieke Claisen-condensatie waarbij één enoliseerbare ester wordt gebruikt, en twee moleculen van dezelfde ester met elkaar reageren:
De gemengde of mixed Claisen-condensatie, waarbij een enoliseerbare ester of keton met een niet-enoliseerbare ester worden gebruikt:
De Dieckmann-condensatie, feitelijk een intramoleculaire condensatie van twee esterfuncties in één molecule:
Mechanisme bewerken
In de eerste stap vindt deprotonering plaats van een ester met een α-proton, waarbij een ester-enolaat wordt gevormd. Vervolgens vindt een nucleofiele aanval van dit enolaat plaats op de carbonyl-functionaliteit van een tweede ester. Een alkoxide dient als leaving group waarna het gevormde enolaat van een β-keto-ester of β-diketon geïsoleerd kan worden door toevoeging van een zuur.
Onder de reactieomstandigheden reageert het gevormde enolaat van de β-keto-ester of het β-diketon niet verder. De lading van de op een na laatste structuur hierboven met een "-" aangegeven negatief geladen koolstofatoom is verdeeld over een aantal atomen zoals in onderstaande figuur is weergegeven. Een reactie van het positief geladen koolstofatoom in de carbonylverbinding treedt dan niet op.