Dicarbonzuur
Dicarbonzuren zijn organische verbindingen met twee carbonzuurgroepen in het molecule: de groep -COOH komt tweemaal voor, wat in elk geval bij de zuren met korte koolstofketens een bijzondere invloed heeft op de fysische eigenschappen. Doordat veel van de dicarbonzuren al eeuwen geleden beschreven zijn, is hun triviale naam vaak bekender dan de systematische aanduiding.
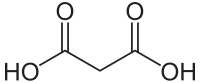
Fysische eigenschappen bewerken
Het feit dat er twee zuurgroepen in het molecule voorkomen heeft invloed op de fysische eigenschappen van de stoffen zoals smeltpunt en zuursterkte van de twee groepen. Vooral in de lagere leden van de dicarbonzuurfamilie treedt een duidelijk verschil op in zuurgraad tussen de eerste en de twee stap. Twee effecten dragen hieraan bij:
- een elektrostatisch effect: na de eerste ionisatiestap is het molecule al negatief geladen en is het moeilijker er een tweede positieve lading vanaf te halen
- de vorming van een interne waterstofbrug
Pas als de keten langer wordt dan ongeveer acht koolstofatomen gaan de zuurgroepen zich onafhankelijk van elkaar gedragen en zijn de verschillen in zuursterkte tussen de eerste en de tweede stap te verwaarlozen. Zie onderstaande tabel voor de verschillende waarden. Dicarbonzuren met meer koolstofatomen in de keten lossen slechter op in water, maar beter in organische oplosmiddelen.
Naamgeving bewerken
Voor de zuren met onvertakte ketens is de systematische naamgeving rechttoe rechtaan: tel het aantal koolstofatomen in de keten, inclusief de koolstofatomen in de zuurgroepen, en voeg achter de naam van de keten de uitgang "dizuur" toe. Het kleinste dicarbonzuur heeft twee koolstofatomen, dus dit is ethaandizuur. Het volgende zuur heet propaandizuur, en zo verder. De algemene formule voor een dicarbonzuur is HOOC-(CH2)n-COOH, met n = 0 bij oxaalzuur, n=1 bij malonzuur, enzovoorts.
Vanuit de systematiek van de naamgeving is het grootste probleem dat vooral de lagere dicarbonzuren (de zuren met de kortere ketens) al heel lang bekend zijn. De meeste zijn al rond 1800 voor het eerst beschreven. Toen was naamgeving op basis van moleculaire structuur niet mogelijk en was de bron waarin het zuur gevonden werd vaak ook de basis voor de naam ervan. Ethaandizuur is daarom veel bekender onder de naam oxaalzuur, naar de klaverzuring waaruit het ooit geïsoleerd is. Propaandizuur is veel bekender onder de naam malonzuur.
Een Amerikaans ezelsbruggetje om de volgorde van de eenvoudigste dicarbonzuren (in hun Engelse benaming, dus bv. succinic acid voor barnsteenzuur) te onthouden luidt: "O my such good apple pie, sweet as sugar!".
Overzicht van dicarbonzuren bewerken
Onderstaande tabel biedt een overzicht van de belangrijkste dicarbonzuren:[1]
| IUPAC-naam | Triviale naam | Zuurrest | Smeltpunt (°C) | pKa1 | pKa2 |
|---|---|---|---|---|---|
| ethaandizuur | oxaalzuur | oxalaat | 189 | 1,23 | 4,19 |
| propaandizuur | malonzuur | malonaat | 136 | 2,83 | 5,69 |
| butaandizuur | barnsteenzuur | succinaat | 185 | 4,19 | 5,48 |
| pentaandizuur | glutaarzuur | glutaraat | 98 | 4,34 | 5,42 |
| hexaandizuur | adipinezuur | adipaat | 152 | 4,42 | 5,41 |
| heptaandizuur | pimelinezuur | pimelinaat | 105 | 4,48 | 5,42 |
| octaandizuur | kurkzuur | suberaat | 142 | 4,52 | 5,40 |
| nonaandizuur | azelaïnezuur | azelaïnaat | 110 | 4,55 | 5,41 |
| decaandizuur | sebacinezuur | sebacaat | 132 | 4,72 | 5,45 |
| tridecaandizuur | brassylzuur | brassylaat | |||
| Z-buteendizuur | maleïnezuur | maleaat | 130 | 1,93 | 6,58 |
| E-buteendizuur | fumaarzuur | fumaraat | - | 3,03 | 4,54 |
| 1,2-benzeendicarbonzuur | ftaalzuur | ftalaat | 2,98 | 5,28 | |
| 1,4-benzeendicarbonzuur | tereftaalzuur | tereftalaat | 3,51 | 4,82 | |
| 2-hydroxy-1,4-butaandizuur | appelzuur | malaat | 128-130 | 3,40 | 5,20 |
| 2,3-dihydroxy-1,4-butaandizuur | wijnsteenzuur | tartraat | 171-174 | 2,89 | 4,40 |
Bronnen, noten en/of referenties
|