Buffercapaciteit
De buffercapaciteit of bufferindex (symbool: β) is een begrip uit de zuur-basechemie en wordt gedefinieerd als de hoeveelheid sterk zuur of sterke base die aan 1 liter buffer moet worden toegevoegd om de pH van het buffermengsel één eenheid te veranderen. De buffercapaciteit zegt dus iets over hoe goed een buffer werkt. Hoe groter de buffercapaciteit, des te beter de buffer de pH-waarde stabiel kan houden bij toevoeging van zuur of base.
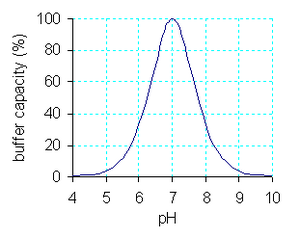
De buffercapaciteit kan ook gedefinieerd worden als het verschil in pH na toevoeging van een kleine hoeveelheid OH−- of H+-ionen, die afkomstig zijn van een sterke base (zoals NaOH) of sterk zuur (zoals HCl).
Berekening bewerken
Een benaderingsformule om de buffercapaciteit te berekenen is:
Hierin is:
- V het volume van de bufferoplossing
- Δn de hoeveelheid (in mol) toegevoegd zuur/base
- ΔpH het verschil in pH (voor en na het toevoegen)
Een praktische methode is een kleine, bekende hoeveelheid buffer met zuur of base te titreren totdat de pH één eenheid veranderd is.
In de regel zullen voor de buffercapaciteit naar de zure en naar de basische kant verschillende waarden gevonden worden, tenzij de pH van de buffer gelijk is aan de pKz-waarde van het zwakke zuur in de buffer.
Zoals in de grafiek te zien is, is de buffercapaciteit van een symmetrische buffer het grootst. De concentraties van de zure en de basische vorm van zijn even groot.
Van Slyke-vergelijking bewerken
Een andere manier om de buffercapapciteit te berekenen is met de formule van Van Slyke:
Hierbij is de C de totale buffer concentratie en de Ka de zuurconstante.
De eenheid die hier heeft, is M. De uitkomst is de hoeveelheid zuur of base die aan de buffer toegevoegd kan worden voor de pH één eenheid verandert.