Kinugasa-reactie
De Kinugasa-reactie is een organische reactie tussen een eindstandig alkyn en een nitronverbinding waarmee een bètalactam gevormd wordt. De reactie verloopt in aanwezigheid van koper(I)zouten in katalytische of stoichiometrische hoeveelheden.
Het oorspronkelijke artikel van Manabu Kinugasa uit 1972 beschreef de reactie van een koper(I)acetylide met een nitron.[1] De reactie werd uitgevoerd in watervrij pyridine bij kamertemperatuur en onder een stikstofatmosfeer. De reactietijd lag tussen 30 minuten en 1 uur. Na hydrolyse en zuivering werd het cis-isomeer bekomen met een opbrengst van 50 tot 60%.[2]
De reactie is van belang voor de synthese van bètalactamantibiotica en andere verbindingen. Met cyclische nitronen met vijf atomen in de ring kan men bijvoorbeeld carbapenams maken, die na dehydrogenering carbapenems opleveren.
De Kinugasa-reactie gaat op met veel verschillende functionele groepen. Er zijn diverse varianten en verbeteringen van de reactie gepubliceerd, onder meer met nieuwe katalysatoren zoals ferrocenen, en chirale katalysatoren die een asymmetrische synthese mogelijk maken.[3] De reactie kan ook intramoleculair opgaan.[4]
Reactiemechanisme bewerken
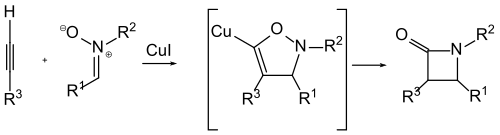
Ding en Irwin stelden in 1976 het volgende reactiemechanisme voor:[5]
Het terminaal alkyn wordt, in aanwezigheid van koper(I) en een base, omgevormd tot een koperacetylide. Dit neemt deel aan een 1,3-dipolaire cycloadditie met het nitron tot de heterocyclische isoxazoline-verbinding (beneden links in het schema). Dit wordt via een intermediaire vorm omgezet tot een enolaat (beneden rechts). Protonering hiervan levert het gewenste bètalactam en zet de koperkatalysator terug vrij.
Bronnen, noten en/of referenties
|