Gabrielsynthese
De gabrielsynthese is een methode om een alkylhalogenide om te zetten naar een primair amine. Hierbij wordt het halogenide 1 gereageerd met kaliumftaalimide (2) ter vorming van een N-gealkyleerd ftaalimide 3. Dit kan dan geconverteerd worden naar het vrije amine met zuur, base of met hydrazine (de zogenaamde Ing-Manskeprocedure). Aldus kan men stellen dat kaliumftaalimide een NH2-synthon is. Deze methode werd voor het eerst beschreven in 1887 door de Duitse scheikundige Siegmund Gabriel in het toenmalig gezaghebbende vaktijdschrift Berichte der Deutschen chemischen Gesellschaft.[1]
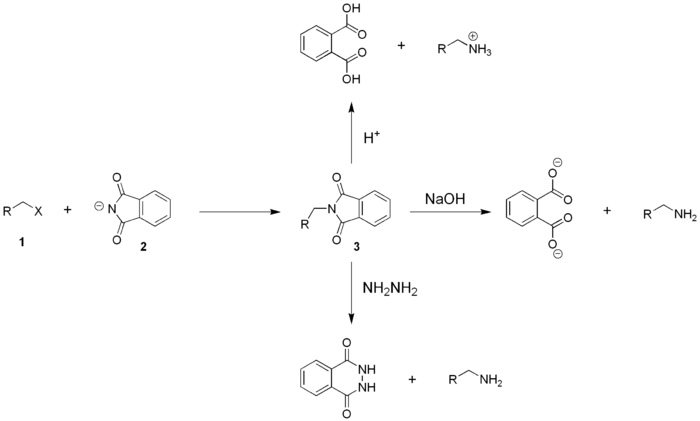
Reactiemechanisme bewerken
Ftaalimide op zichzelf is niet reactief genoeg om gealkyleerd te worden door een alkylhalogenide, waardoor het nodig is om eerst het corresponderende natrium- of kaliumzout te maken. Dikwijls wordt kaliumftaalimide (2, het kaliumzout van ftaalimide) gebruikt, wat makkelijk te bekomen is door reactie van ftaalimide met KOH. Het aldus bekomen kaliumftaalimide is een nucleofiel en zal door een alkylhalogenide (1) N-gealkyleerd worden. Voor het resulterende N-alkylftaalimide 3 kunnen meerdere resonantiestructuren getekend worden. Naast 3 wordt eveneens kaliumhalogenide als nevenproduct gevormd. Vervolgens wordt het primaire amine vrijgezet door zure of alkalische hydrolyse van 3, of door een hydrazine uitwisselingsreactie (Ing-Manskeprocedure).
Toepassingen bewerken
De gabrielsynthese is vooral nuttig omdat het eindproduct niet gecontamineerd is met secundaire en/of tertiaire amines. De reactie verloopt relatief traag maar kan versneld worden door aprotische polaire solventen (bijvoorbeeld DMF) of een kroonether te gebruiken. Omzetten van het N-alkylftaalimide 3 naar het vrije amine kan op verschillende manieren gebeuren:
- zure hydrolyse (deze procedure kan echter nevenreacties met zich meebrengen);
- alkalische hydrolyse;
- Ing-Manskeprocedure:[2] in deze methode zet men het amine vrij door 3 te laten reageren met hydrazine. Als nevenproduct wordt ftaalhydrazide gevormd;
- natriumboorhydride-isopropanol en azijnzuur;[3]
- 40% aq methylamine.[4]
Een stereochemische toepassing van de gabrielsynthese vindt men in het volgende voorbeeld:[5]
Een alcohol (4) wordt met DEAD en kaliumftaalimide omgezet naar 5, hetwelke vervolgens wordt gerefluxeerd in een mengsel van hydrazine en ethanol om amine 6 vrij te zetten. DEAD kent vooral veel toepassingen binnen de Mitsunobu-reactie.
Zie ook bewerken
| Referenties |