Dikobaltoctacarbonyl
Dikobaltoctacarbonyl is het anorganische kobaltverbinding met als formule Co2(CO)8. De stof komt voor als oranje kristallen, die onoplosbaar zijn in water. De stof is pyrofoor.
| Dikobaltoctacarbonyl | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Molecuulmodel van dikobaltoctacarbonyl
(isomeer 1) | ||||
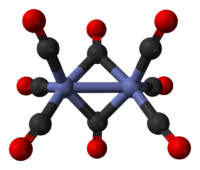
| ||||
Molecuulmodel van dikobaltoctacarbonyl
(isomeer 2) | ||||
| Algemeen | ||||
| Molecuulformule | Co2(CO)8 | |||
| IUPAC-naam | dikobaltoctacarbonyl | |||
| Molmassa | 343,96308 g/mol | |||
| SMILES | [CH-]=O.[CH-]=O.[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[Co].[Co+2]
| |||
| CAS-nummer | 10210-68-1 | |||
| EG-nummer | 233-514-0 | |||
| PubChem | 25049 | |||
| Wikidata | Q421481 | |||
| Beschrijving | Oranje kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H304 - H315 - H317 - H351 - H361 - H373 - H412 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P280 - P301+P310 - P331 | |||
| Opslag | Gescheiden van sterk oxiderende stoffen. Goed gesloten en in een goed verluchte ruimte bewaren. | |||
| VN-nummer | 3281 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| MAC-waarde | 0,1 mg/m³ | |||
| LD50 (ratten) | (oraal) 754 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | oranje | |||
| Dichtheid | (bij 18°C) 1,73 g/cm³ | |||
| Smeltpunt | 51 °C | |||
| Kookpunt | 52 °C | |||
| Dampdruk | (bij 20°C) ±200 Pa | |||
| Goed oplosbaar in | hexaan | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | monoklien | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese bewerken
Dikobaltoctacarbonyl kan worden bereid uit een reactie van kobalt(II)-zouten en koolstofmonoxide onder hoge druk. De reactie gaat meestal door in aanwezigheid van een cyanide, die min of meer dienstdoet als katalysator.
Isomerie bewerken
In een hexaan-oplossing bestaat de stof als 2 isomeren, die snel in elkaar kunnen overgaan:
De minst stabiele structuur is die waarin een enkele Co-Co-verbinding aanwezig is (links). De andere structuur is dominanter en heeft 2 zogenaamde brugverbindingen (Co-CO-binding). Het overgaan van de ene in de andere structuur gaat meestal van de minst naar de meest stabiele structuur (lange pijl naar rechts). De afstand tussen de kobaltatomen bedraagt bij beide structuren 2,52 ångström, de afstanden tussen de Co-CO (gewone binding) en de Co-CO-binding (brugbinding) bedragen respectievelijke 1,80 en 1,90 ångström.[1]
Toxicologie en veiligheid bewerken
De stof ontleedt bij verwarming of onder invloed van lucht, met vorming van giftige dampen van koolstofmonoxide en kobalt. Ze reageert met oxiderende stoffen, waardoor kans op brand ontstaat.
De stof is irriterend voor de ogen en de huid, en sterk irriterend voor de luchtwegen. Inademing van kan longoedeem veroorzaken.
Externe links bewerken
Bronnen, noten en/of referenties
|

