Digallaan
Digallaan is een anorganische chemische verbinding met de formule , wat ook wel genoteerd wordt, met meer nadruk op de structuur van de verbinding, als of (de μ geeft aan dat de twee waterstofatomen gebonden zijn aan beide gallium-atomen). Digallaan is het dimeer van gallaan . De uiteindelijke synthese is in 1998 voor het eerst beschreven als een chemische "tour de force",[1][2][3] hoewel later werk van Greenwood en anderen dat niet kon bevestigen.[4] Digallaan is voor het eerst in 1941 beschreven.[5] De verbinding is een kleurloos gas dat bij 0 °C ontleedt.
| Digallaan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
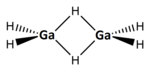
| ||||

| ||||
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | digallaan(6) | |||
| Andere namen | Di-μ-hydrido-tetrahydridodigallium Dimeer van gallaan | |||
| Molmassa | 145,494 g/mol | |||
| SMILES | [GaH2]1[H] [GaH2] [H]1
| |||
| CAS-nummer | 12140-58-8 | |||
| Wikidata | Q516785 | |||
| Beschrijving | Witte, vaste stof Kleurloos gas | |||
| Fysische eigenschappen | ||||
| Kookpunt | ontleed | |||
| Sublimatiepunt | −50 °C | |||
| Oplosbaarheid in water | ontleed | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese bewerken
Digallaan is ten opzichte van gallaan stabieler, het zelfde geldt ook voor de verbindingen die bij de synthese betrokken zijn. De synthese van gallaan verloopt in twee stappen.
- In de eerste stap wordt monochloorgallaan gemaakt uit gallium(III)chloride, eigenlijk , en trimethylsilaan. In het monochloride vormen de twee chlooratomen de bruggen tussen de gallium-centra:
- Net als in digallaan zelf geeft de "μ" aan dat de chlooratomen aan beide gallium-atomen gebonden zijn.
- De tweede stap is de oplosmiddelvrije reactie bij −23 °C van het in de vorige stap gevormde monochloorgallaan met lithiumtetrahydrogallaat waarbij, zij het in lage opbrengst, digallaan ontstaat.
Onder de reactiecondities is digallaan een gas, maar bij −50 °C rijpt het tot een witte vaste stof.
Bij opwarmen tot 0 °C ontleed de stof in zijn elementen:
Structuur bewerken
Elektronendiffractie van de damp bij 255 K ( ≈ −18 °C) toonde aan dat in de gasfase de structuur van digallaan vergelijkbaar is met die van diboraan: twee -groepen worden aan elkaar gekoppeld door twee waterstof-atomen in een 3-centra-2-elektronbinding.[2]. De afstand van de eindstandige (of ook wel terminale) waterstof-atomen tot gallium is 158 pm, de bruggende waterstof-atomen hebben een afstand van 171 pm tot beide gallium-atomen. De Ga-H-Ga-hoek is 98°. Het Proton-NMR van digallaan in tolueen laat twee duidelijke signalen zien, die op basis van hun intensiteit eenvoudig zijn toe te wijzen aan de eindstandige of bruggende waterstofatomen.[2]
In de vaste fase blijk digallaan een oligo- of polymere structuur aan te nemen. Het elektronendiffractiespectrum is in overeenstemming met eenheden van vier -groepen.[2] Uit het spectrum is ook af te leiden dat er eindstandge waterstofatomen aanwezig zijn, dit in tegenstelling tot aluminiumhydride (of allaan) waarin alle waterstof-atomen een bruggende functie hebben.
| Bronnen, noten en/of referenties
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Digallane op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
|




