Diastereomeer
| Diastereomeren | |
|---|---|
|
|

|

|
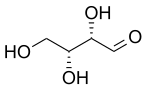
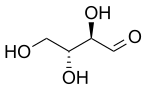
| D-Threose | D-Erythrose |
Diastereomeren zijn stereo-isomeren die geen enantiomeer (spiegelbeelden) van elkaar zijn. Twee stereo-isomeren zijn diastereomeren van elkaar als er één of meer chirale centra verschillend zijn en ten minste één of meer andere chirale centra gelijk.
Diastereomeren hebben verschillende fysieke en chemische eigenschappen.
Koolhydraten hebben veel paren diastereomeren, bijvoorbeeld D-Ribose en D-Arabinose. Indien er precies één chiraal centrum verschillend is wordt dit vooral in de suikerchemie een epimeer genoemd.
CH=O CH=O | | HC-OH HO-CH | | HC-OH HC-OH | | HC-OH HC-OH | | CH2OH CH2OH D-Ribose D-Arabinose
In bovenstaande tekening lijkt het alsof het tweede koolstofatoom alleen maar een halve slag gedraaid is. Dit is het nadeel van het tekenen van een ruimtelijke structuur in het platte vlak. De vier bindingen rond koolstof wijzen als kraaienpootjes naar de vier hoekpunten van een tetraëder. In de tekening hierboven is de afspraak dat het "koolstof-kraaienpootje" op twee punten staat, er steken dus ook twee punten omhoog. De verticale bindingen zijn de punten waarop het koolstofatoom staat, ze staan dus naar achteren. Als het tweede koolstofatoom precies in het vlak van de tekening ligt, bevinden de koolstofatomen 1 en 3 zich erachter. De horizontaal getekende bindingen wijzen naar voren. Het waterstofatoom en de hydroxylgroep staan dus naar voren.
Bindingen tussen koolstofatomen kunnen draaien en meestal levert dat een identieke situatie op. De atomen zijn wel van plaats verwisseld, maar we kunnen tussen twee waterstofatomen geen onderscheid maken. Als het tweede koolstofatoom van D-ribose een halve slag gedraaid wordt is het gevolg dat de koolstofatomen 1 en drie vóór het vlak van de tekening komen, terwijl de twee andere groepen naar de achterzijde van de tekening verschuiven. Van de bovenkant gezien lijkt het alsof D-ribose daarmee is omgezet in D-arabinose, maar kijk je aan de zijkant, dan valt de knik in het molecule duidelijk op. Dan is ook duidelijk dat een halve slag draaien van het 2e koolstofatoom niet voldoende is om de twee moleculen identiek te maken.